
- •Письменная консультация по теме:
- •1.1. Простое вещество (н2, f2, Cl2, Br2, i2)
- •1.2. Сложное вещество (hf, hCl, hBr, hi)
- •2. Трехатомные молекулы (4а подгруппа – SiCl2, PbBr2… и 6a подгруппа - н2s, н2Se…)
- •3. Четырехатомные молекулы (5а подгруппа –SbН3, pСl3, pн3, …)
- •4. С гибридизацией ао
- •4.4. В гибридизации участвуют не только ао связывающих электронов, но и ао неподеленных электронных пар (нп)
- •Взаимодействия между частицами вещества
- •Донорно-акцепторное взаимодействие молекул
- •Водородная межмолекулярная связь
- •Свойства твердых тел
- •Виды кристаллов и их свойства.
- •1. Молекулярный.
- •2. Ионный
- •3. Атомно-ковалентный
- •4. Металлический
- •Характеристики некоторых веществ в твердом кристаллическом состоянии
- •Типы кристаллических решеток
1.1. Простое вещество (н2, f2, Cl2, Br2, i2)
Механизм образования связи
- обменный
Структура молекулы - линейная
связь неполярная: µсв= 0,
молекула неполярнаяµм=∑ µсв= 0
Простое вещество N2,
М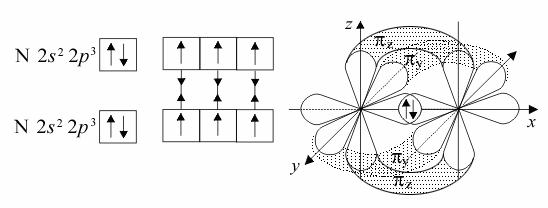 еханизм
образования связи
еханизм
образования связи
- обменный
Структура молекулы - линейная
связь неполярная: µсв= 0,
молекула неполярнаяµм=∑ µсв= 0
Образование тройной связи в молекуле азота N2: одна сигма- и две пи-связи. Кратность связи равна трем.
1.2. Сложное вещество (hf, hCl, hBr, hi)
Молекула HCl
![]()
Механизм образования связи – обменный.
Структура молекулы - линейная
ЭО(H)= 2,1 ЭО(Cl)=3,0 ∆ЭО=0,9Þсвязь полярная: µсв≠ 0,
Молекула полярнаяµм=∑ µсв≠ 0
Молекула НI:
1s -АО атомаHперекрываются с 5p– АО атома иода, имеющими по одному неспаренному электрону:

![]()
HI
Механизм образования связи - обменный.Тип связи -s-связь.
Кратность связи - 1, структура молекулы – линейная.
Связь – полярная,так как образована атомами с разной ЭО ЭО(I) = 2,5 ЭО(H) = 2,1
связывающая электронная пара смещена в сторону I:эффективный отрицательный заряд (δ-) у атомаI, эффективный положительный заряд (δ+) у атома Нвозникает электрический диполь.
Молекула полярнаяµм=∑ µсв≠ 0
М
 олекула
СО
олекула
СО
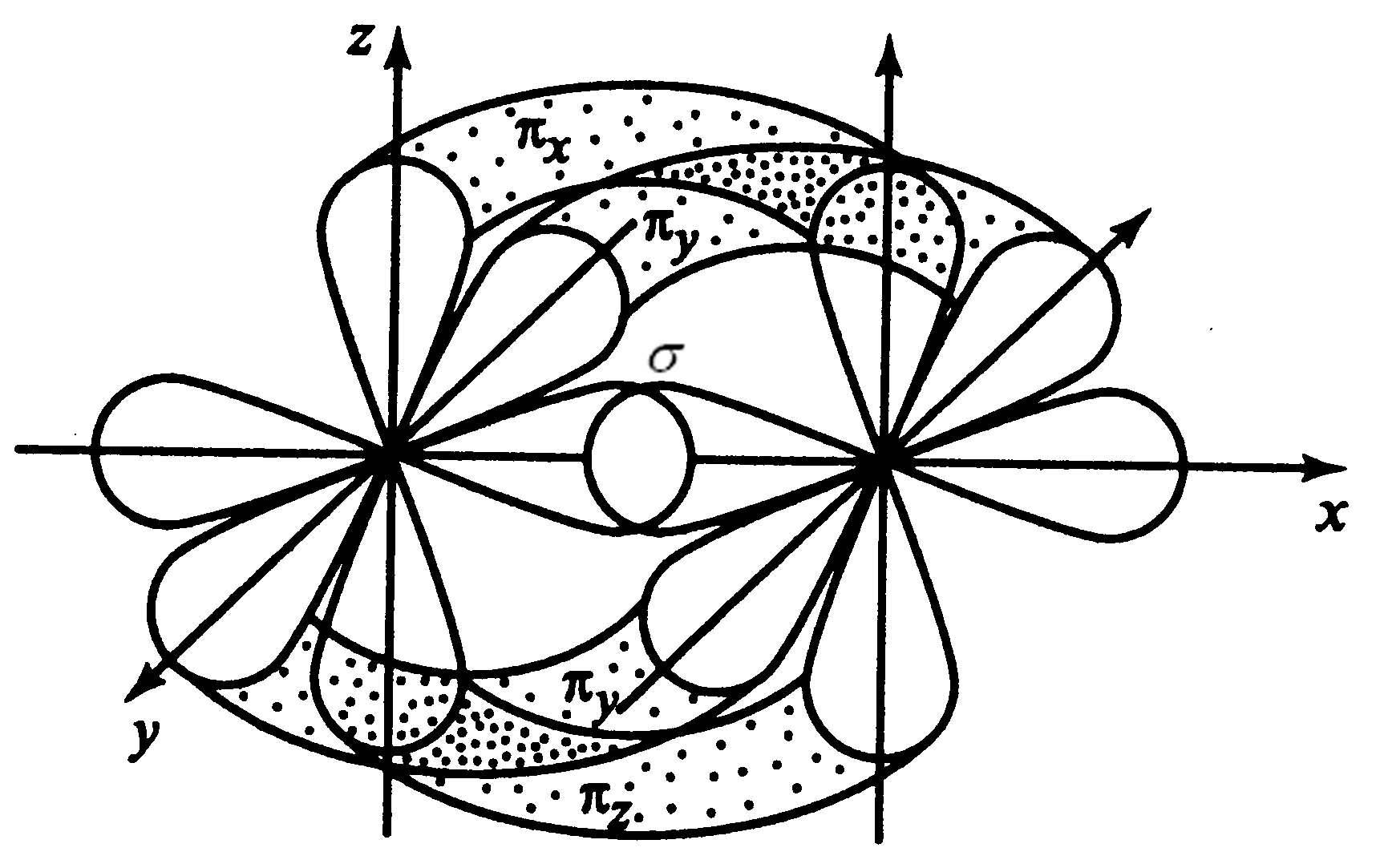
Между атомами CиOобразуются 3 связи:двепо обменному механизму иоднапо донорно-акцепторному механизму:O- донор,C- акцептор.3 ковалентные связи образуются за счет перекрывания 3-хр-АО каждого атома:s– связь и двеp-связи
Структура молекулы - линейная
ЭО(С)= 2,5 ЭО(О)=3,5 ∆ЭО=1,0 Þсвязь полярная: µсв≠ 0, С→О
молекула полярнаяµм=∑ µсв≠ 0 С→О
2. Трехатомные молекулы (4а подгруппа – SiCl2, PbBr2… и 6a подгруппа - н2s, н2Se…)
Молекула Н2S
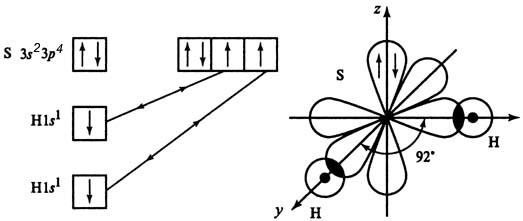
Механизм образования связи - обменный
Валентный угол 92о, структура молекулы –угловая
ЭО(Н) = 2,1 ЭО(S) = 2,5 ∆ЭО=0,4Þсвязь полярная: µсв≠ 0,
молекула полярнаяµм=∑ µсв≠ 0

 µсв
µсв
µсв
 µм
µм
3. Четырехатомные молекулы (5а подгруппа –SbН3, pСl3, pн3, …)
Молекула PН3
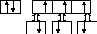 P…3s23p3
P…3s23p3
Н 1s1 Н 1s1 Н 1s1
Механизм образования связи - обменный
Структура молекулы – тригональная пирамида
ЭО(Н) = 2,1 ЭО(Sb) = 1,9 ∆ЭО=0,2ÞТ.к. ∆ЭО≠0Þсвязь полярная: µсв≠ 0,
молекула полярнаяµм=∑ µсв≠ 0
4. С гибридизацией ао
|
Тип гибридизации |
Структура молекулы |
Валентный угол |
|
sp |
|
180о |
|
sp2 |
|
120о |
|
sp3 |
|
109,3о |
4.1 sp-гибридизация (2А подгруппа или d-элемент)
Молекула ВеСl2
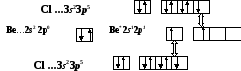
![]()
Cl Be Cl
sp-гибридизация АО Ве , валентный уголÐ180о
пространственная структура линейная,
связь полярная mсв ¹0, т.к. ЭО(Ве) = 1,5, ЭО(Cl)= 3,0 и ∆ЭО≠0
mмол =Smсв = 0Þмолекула в целом неполярнаяCl¬Be®Cl
4.2. sp2-гибридизация (3А подгруппа)
М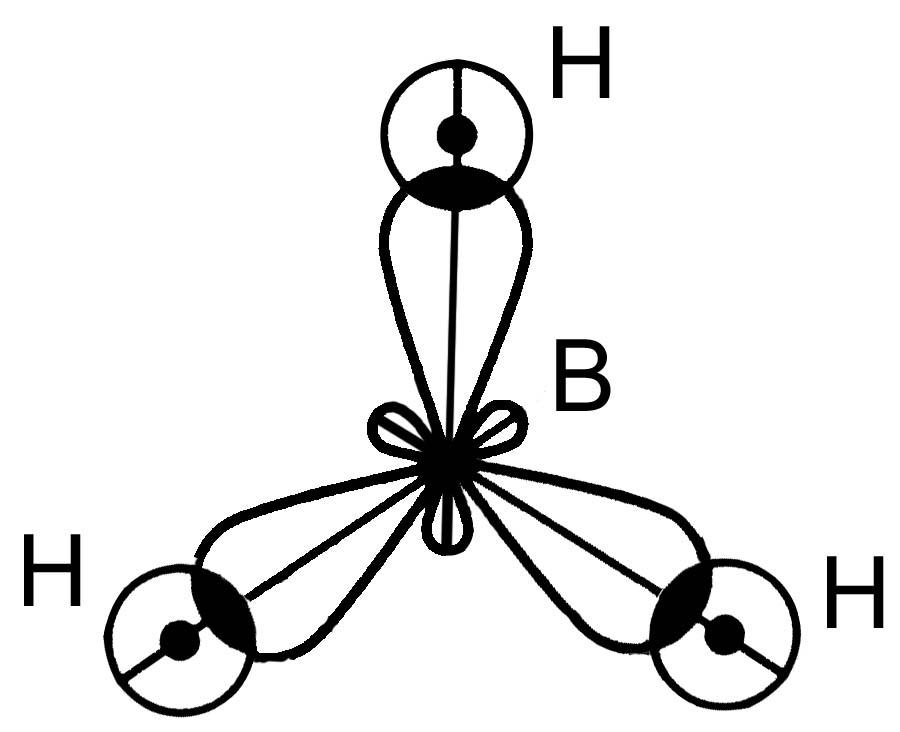 олекула
ВН3
олекула
ВН3
 В*
2s1
2p2
В*
2s1
2p2
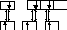
H 1s H 1s H 1s
s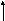 p2–гибридизация
АО В, 3s- связи,Ð120°, связи полярныеDЭО
= (2.1-2.0)¹0,mсв ¹0
p2–гибридизация
АО В, 3s- связи,Ð120°, связи полярныеDЭО
= (2.1-2.0)¹0,mсв ¹0
структура молекулы - плоский треугольник
m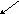
 мол
=Smсв= 0Þмолекула ВН3- неполярная
мол
=Smсв= 0Þмолекула ВН3- неполярная
Аналогично для BCl3, ноBFCl2– полярная молекула mмол = Smсв ≠ 0
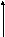
F
 mмол
mмол

BFCl2 Cl Cl
4.3. sp3-гибридизация (4А подгруппа)
Молекула SnCl4
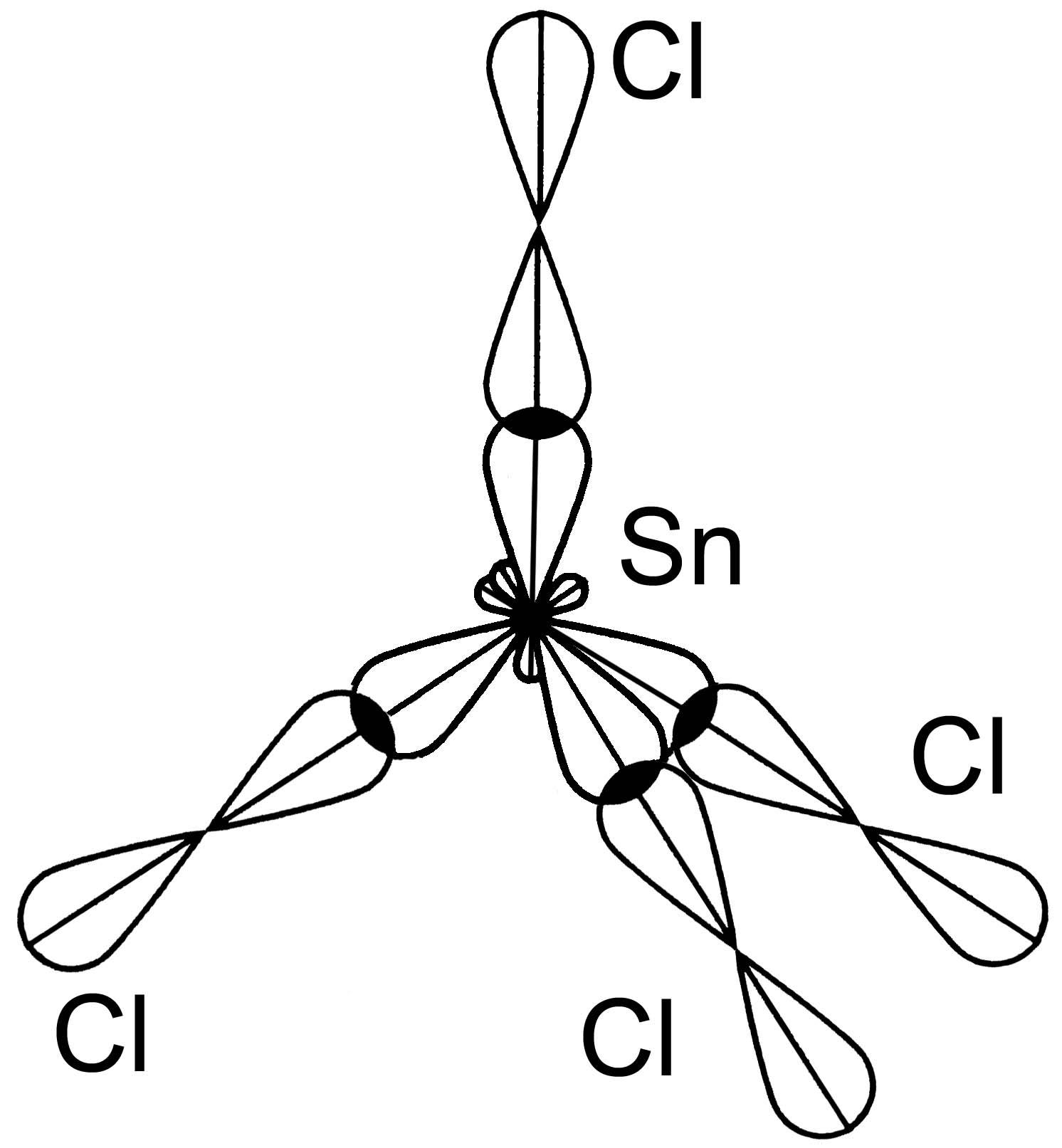 Si*
5s
5p
Cl
3s
3p
Si*
5s
5p
Cl
3s
3p

 Cl
Cl
Cl
Cl
Cl
Cl
одна s-АО и трир-АОÞsp3- гибридизация АОSnm св
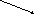
 структура молекулыÞтетраэдр,Ð109,30
структура молекулыÞтетраэдр,Ð109,30
связи полярные DЭО = (3.0-1.8)¹0,mсв ¹0
Smсв= 0 - молекула в целом неполярная
Аналогично для СCl4но СFCl3 – полярная молекула

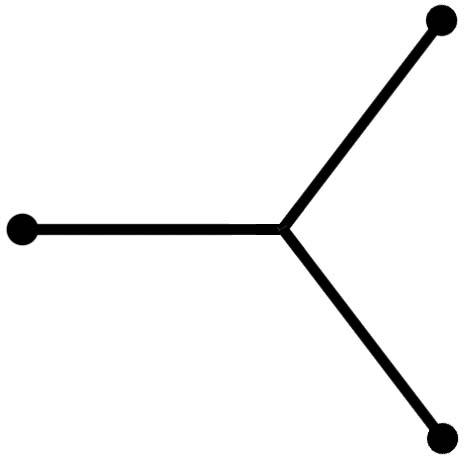 плоский треугольник
плоский треугольник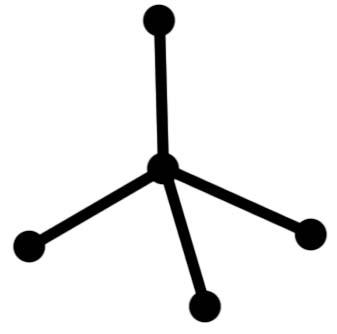 тетраэдр
тетраэдр