
- •Механика, молекулярная физика и термодинамика Учебное пособие
- •Омск 2007
- •Введение
- •Разделы содержания теоретического курса, представленные в пособии
- •1. Физические основы механики
- •2. Молекулярная физика и термодинамика
- •I. Механика и элементы специальной теории относительности
- •1. Кинематика поступательного и вращательного движений материальной точки
- •1.1. Кинематические характеристики движения материальной точки
- •1.2. Тангенциальная и нормальная составляющие ускорения
- •1.3. Основная задача кинематики
- •1.4. Вращательное движение и его кинематические характеристики
- •2. Динамика поступательного и вращательного движений
- •Законы Ньютона Первый закон Ньютона: всякое тело находится в состоянии покоя или равномерного прямолинейного движения, пока воздействие со стороны других тел не выведет его из этого состояния.
- •Третий закон Ньютона: силы, с которыми действуют друг на друга взаимодействующие тела, равны по величине и противоположны по направлению:
- •2.2. Динамика вращательного движения твердого тела
- •3. Работа и механическая энергия
- •3.1. Работа и мощность при поступательном и вращательном движениях
- •3.2. Консервативные и неконсервативные силы
- •3.3. Кинетическая энергия при поступательном и вращательном движениях
- •3.4. Потенциальная энергия
- •4. Законы сохранения в механике
- •4.1. Закон сохранения механической энергии
- •4.2. Закон сохранения импульса. Центральный удар двух тел
- •4.3. Закон сохранения момента импульса
- •5.3. Релятивистские масса и импульс. Взаимосвязь массы и энергии
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •Контрольное задание №1
- •II. Основы молекулярной физики и термодинамики
- •1. Молекулярно-кинетическая теория идеальных газов
- •1.1. Уравнение состояния
- •1.2. Уравнение состояния Ван-дер-Ваальса
- •1.3. Внутренняя энергия
- •1.4. Статистические распределения
- •1.4.1. Распределение Максвелла
- •1.4.2. Распределение Больцмана
- •1.5. Среднее число столкновений и средняя длина свободного пробега молекул
- •1.6. Явления переноса в газах
- •2. Основы термодинамики
- •2.1. Первое начало термодинамики
- •2.2. Работа газа при изменении его объема
- •2.3. Теплоемкость
- •2.4. Применение первого начала термодинамики к изопроцессам
- •2.5. Адиабатический процесс
- •2.6. Обратимые и необратимые процессы. Коэффициент полезного действия теплового двигателя
- •2.7. Второе начало термодинамики
- •2.8. Цикл Карно и теорема Карно
- •2.9. Термодинамическое неравенство Клаузиуса. Энтропия
- •2.10. Фазовое пространство. Микро- и макросостояния системы
- •2.11. Статистический вес (термодинамическая вероятность) макросостояния и его связь с энтропией
- •Примеры решения задач
- •Для расчета средней квадратичной скорости выражение (1) удобно преобразовать, умножив числитель и знаменатель на na:
- •На основании первого начала термодинамики
- •Так как точки в и с принадлежат адиабате вс, то
- •Задачи для самостоятельного решения
- •Контрольное задание №2
- •Библиографический список
- •Содержание
- •Разделы содержания теоретического курса, представленные в пособии...…4
2. Основы термодинамики
2.1. Первое начало термодинамики
Внутренняя энергия макроскопической системы качественно отличается от механической энергии частиц, образующих систему. Это проявляется в существовании двух форм изменения внутренней энергии – работы и теплопередачи (теплообмена). Работа совершается в тех случаях, когда при взаимодействии системы с окружающими телами возникает какое-либо упорядоченное движение. В частности, газ совершает работу только при изменении его объема. В процессе теплопередачи также может происходить изменение внутренней энергии, обусловленное изменением энергии частиц, образующих систему, и не связанное с совершением работы. Изменение внутренней энергии в этом случае измеряется количеством тепла.
Закон сохранения энергии, в котором учитывается особая форма передачи энергии путем теплопередачи, является фундаментальным законом физики и называется первым началом термодинамики: «Количество тепла, полученное системой, расходуется на приращение внутренней энергии системы и на совершение системой работы над внешними телами (системами)».
Первое начало сформулировано на основании обобщения опытных фактов и справедливо для всех тепловых процессов. Последнее соотношение является термодинамическим определением внутренней энергии системы.
«Внутренняя энергия системы является функцией ее состояния, определенной с точностью до произвольной постоянной, приращение которой равно разности между количеством тепла, полученным системой, и работой, совершенной системой в ходе теплового процесса».
Изменение внутренней энергии зависит только от начального и конечного состояний системы. Работа и количество тепла зависят от вида процесса, переводящего систему из начального состояния в конечное, т.е. они не являются функциями состояния системы.
Если система периодически возвращается в первоначальное состояние, то U=0 иA=Q, т.е. нельзя построить вечный двигатель, который совершал бы большую по величине работу, чем количество сообщенной ему извне энергии.
По форме обмена энергией можно выделить три вида систем:
1) изолированные (Q=0,A=0),
2) теплоизолированные (адиабатические) (Q=0,A0),
3) тепловые резервуары (A=0,Q0).
2.2. Работа газа при изменении его объема
Найдем работу, совершаемую газом при изменении его объема. Рассмотрим газ, находящийся под поршнем в цилиндрическом сосуде (рис. 17).
Е сли
газ, расширяясь, передвигает поршень
на расстояниеdx, то он
производит работу против сил внешнего
давления ре:
сли
газ, расширяясь, передвигает поршень
на расстояниеdx, то он
производит работу против сил внешнего
давления ре:
![]() ,
,
где Sплощадь поршня,dVизменение объема газа. Полная работа А12, совершаемая газом при изменении его объема отV1доV2:
 .
.
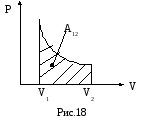
Если процесс расширения газа является равновесным, т.е. идущим без перепадов давлений и температур, то работа может быть вычислена через давление самого газа (ре=р). Графически работа газа равна площади под кривой процесса на диаграммеPV(рис.18). Если газ совершает круговой процесс (цикл), то работа будет равна площади цикла.
Работа газа при изопроцессах:
1) изохорический V=const,dV=0,A12=0;
2)
изотермический T=const,
![]() ;
;
3)
изобарический р=const,![]()
2.3. Теплоемкость
Теплоемкость телаили системыскалярная физическая величина, характеризующая процесс теплообмена и равная количеству тела, полученному системой при изменении его температуры на один кельвин.
![]()
Теплоемкость можно отнести к одному молю или к единице массы вещества. Соответствующие теплоемкости называются молярнойСилиудельнойс. Единицами измерения теплоемкостей являются: Дж/К (полная теплоемкость), Дж/(мольК) (молярная теплоемкость), Дж/(кгК) (удельная теплоемкость). Зная теплоемкости, можно вычислить количество тепла, полученное системой:
Q=CT,Q=CT,Q=cMT.
Теплоемкость, как и количество тепла, зависит от вида теплового процесса. Различают теплоемкости при постоянном давлении и постоянном объеме, если в процессе нагревания вещества поддерживаются постоянными соответственно давление и объем. Если газ нагревается при постоянном объеме, то работа внешних сил равна нулю и сообщенная газу извне теплота идет на увеличение его внутренней энергии:
 .
.
Используя первое
начало термодинамики, можно показать,
что молярная теплоемкость газа при
постоянном объеме CV
и молярная теплоемкость газа при
постоянном давленииCP
связаны соотношением
![]() .
Это соотношение называетсяуравнением
Майера.
.
Это соотношение называетсяуравнением
Майера.
При рассмотрении тепловых процессов важно знать характерное для каждого газа отношение CPкCV, которое называется показатель адиабаты или коэффициент Пуассона:
![]()
Из последних формул следует, что молярные теплоемкости не зависят от температуры в тех областях, где =const.
