
Primery_reshenia_zadach_po_teme_2
.doc
Примеры решения задач по теме № 2
«Основы молекулярной физики и термодинамики»
Задача 1 Используя функцию распределения Максвелла по скоростям, найдите наиболее вероятное значение кинетической энергии атомов гелия, который при давлении р = 105 Па имеет плотность =160 г/м3.
|
Дано: p = 105 Па = 160 г/м3 = 0,16 кг/м3 |
|
|
Запишем функцию распределения Максвелла по скоростям.
![]() .
.
Поскольку
нужно найти наиболее вероятное значение
энергии, имеет смысл перейти от
распределения по скоростям к распределению
по энергиям f(![]() ).
По смыслу функции распределения
относительное число молекул, скорости
которых лежат в интервале скоростей
).
По смыслу функции распределения
относительное число молекул, скорости
которых лежат в интервале скоростей
![]() ,
которому соответствует интервал энергий
,
которому соответствует интервал энергий
![]() ,
равно
,
равно
![]() .
.
Из
данного выражения можно получить
соотношение связывающее две функции
распределения:
![]() .
Из формулы видно, что для перехода от
распределения по скоростям к распределению
по энергиям недостаточно просто выразить
скорость через энергию. Поскольку
.
Из формулы видно, что для перехода от
распределения по скоростям к распределению
по энергиям недостаточно просто выразить
скорость через энергию. Поскольку
![]() ,
,
 ,
производная
,
производная
 ,
и выражение для распределения по
энергиям будет иметь вид
,
и выражение для распределения по
энергиям будет иметь вид
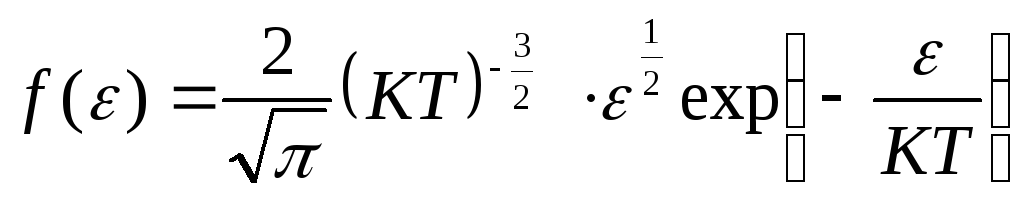 .
.
Наиболее
вероятное значение энергии
![]() соответствует максимуму функции
распределения. Соответственно производная
соответствует максимуму функции
распределения. Соответственно производная
![]() должна быть равна нулю:
должна быть равна нулю:
 ,
,
 ,
,
 ,
,
![]() .
.
Обращаем
внимание, что выражение наиболее
вероятной энергии нельзя получить,
подставив в формулу
![]() выражения наиболее вероятной скорости
выражения наиболее вероятной скорости
![]() (в этом случае получилось бы
(в этом случае получилось бы
![]() ).
).
Из
уравнения МенделееваКлапейрона
следует, что
![]() , значит
, значит
![]()
(в
последней формуле учтено, что R
= NA·k).
Подставляя данные из условия и молярную
массу гелия
![]() = 4·10-3
кг/моль,
получим
= 4·10-3
кг/моль,
получим
![]() Дж.
Дж.
Ответ:
![]() Дж.
Дж.
Задача 2 Пылинки массой 10-18 г взвешены в воздухе. Определить толщину слоя воздуха, в пределах которого концентрация пылинок различается не более чем на 1%. Температура воздуха во всем объеме одинакова: Т=300 К.
Дано:
|
m1 = 10-21 кг T = 300 К
|
Решение При равновесном распределении пылинок их концентрация зависит только от координаты z по оси, направленной вертикально. По распределению Больцмана: n=n0e-u/kT=n0e-mgz/kT. (1)
Дифференцируя выражение (1) по z, получим |
|
Z - ? |
dn=-n0![]() e-mgz/kTdz.
e-mgz/kTdz.
Так
как n0e-mgz/kT=n,
то dn=![]() ndz.
Отсюда
ndz.
Отсюда
![]() .
.
Знак «-» показывает, что положительным изменениям координаты (dz>0) соответствует уменьшение относительной концентрации (dn<0). Знак «-» опускаем и заменяем dz и dn конечными приращениями z и n:
![]() .
.
n/n=0,01 по условию задачи. Подставляя значения, получим z=4,23 мм.
Ответ: z=4,23 мм.
Задача 3 В сосуде объёмом V = 1 л находится углекислый газ массой m = 0,2 г. При температуре T =2600 K некоторая часть молекул диссоциировала на молекулы кислорода и окиси углерода. При этом давление газа в сосуде оказалось равным 108 кПа. Определить, какая часть молекул диссоциировала.
|
Дано: V = 1 л = 10-3 м3 m = 0,2 г = 210-4 кг Т = 2600 К Р = 108 кПа = 1,08105 Па |
|
α -? |
Рассмотрим уравнение диссоциации углекислого газа
![]()
Таким образом, каждый моль углекислого газа, распадаясь вызывает появление одного моля окисла углерода и половину моля кислорода. В результате распада части молекул в сосуде будут находиться три газа: CO2, CO, O2.
По закону Дальтона найдём выражение для давления, создаваемого данной смесью газов
![]() .
.
Введём
степень диссоциации
![]() -
отношение числа молей распавшихся
молекул к начальному числу молей вещества
-
отношение числа молей распавшихся
молекул к начальному числу молей вещества
![]() .
Тогда число молей CO2
.
Тогда число молей CO2
![]() ,
,
число
молей CO
![]() ,
,
число
молей O2
(с
учётом уравнения реакции)
![]() .
.
И![]() з
уравнения Менделеева–Клапейрона
з
уравнения Менделеева–Клапейрона
![]() ,
,
![]() ,
,
![]() .
.
Общее
давление будет связано со степенью
диссоциации
![]() уравнением
уравнением
![]() .
.
Так
как
![]() (
= 44·10-3
кг/моль
– молярная масса CO2),
то
(
= 44·10-3
кг/моль
– молярная масса CO2),
то
![]() .
Выражая
.
Выражая
![]() и производя расчет, получим
и производя расчет, получим
![]() .
.
Ответ: = 0,2.
Задача 4
В результате некоторого процесса
вязкость некоторого идеального газа
увеличилась в
![]() раза,
а коэффициент диффузии – в
раза,
а коэффициент диффузии – в
![]() раза.
Во сколько раз увеличилось давление
газа.
раза.
Во сколько раз увеличилось давление
газа.
Решение
|
Дано:
|
|
|
![]() ,
,
![]() ,
,
где

средняя длина свободного пробега,
средняя длина свободного пробега,
![]() -
средняя скорость движения молекул,
= m0n
плотность газа.
-
средняя скорость движения молекул,
= m0n
плотность газа.
По
основному уравнению МКТ
![]() ,
поэтому
,
поэтому
![]() .
Подставим в выражение
значения
.
Подставим в выражение
значения
![]() ,
,
![]() и ,
тогда
и ,
тогда
![]()
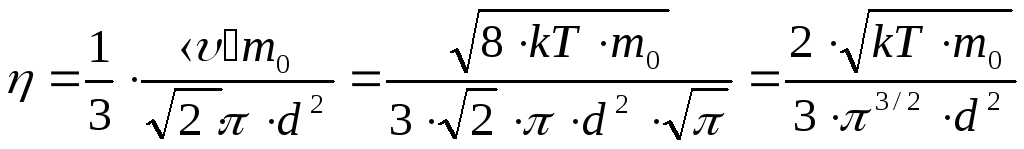 .
.
Из
формул видно, что
![]() ~
~![]() ,
значит,
,
значит,
![]() .
Для того чтобы найти отношение
.
Для того чтобы найти отношение
![]() ,
свяжем между собой
,
свяжем между собой
![]() и D.
Из формул видно, что
и D.
Из формул видно, что
![]() .
Отсюда
.
Отсюда
![]() ,
а отношение
,
а отношение
![]() .
В итоге получаем отношение давлений
.
В итоге получаем отношение давлений
![]()
![]() .
.
Ответ: давление возрастет в два раза.
Задача 5 Газ, занимавший объем 2 л при давлении 0,1 МПа, расширился изотермически до 4 л. После этого, охлаждая газ изохорически, уменьшили давление в 2 раза. Далее газ изобарически расширился до 8 л. Начертите график зависимости давления от объема, найдите работу, совершенную газом.
|
Дано: V1 = 2 л = 210-3 м3 P1= 0,1 МПа = 0,1106 Па V2 = 4 л = 410-3 м3
P3
=
V3 = 8 л = 810-3 м3 |
|
A - ? |
Построим
график зависимости давления от объема.
Первый процесс, происходящий с газом,
является изотермическим. Выразим
давление через объём и температуру при
помощи уравнения Менделеева – Клапейрона
![]() .
Так как T
= const,
давление в данном процессе обратно
пропорционально объёму, и линия,
изображающая данный процесс на p-V
диаграмме, будет участком гиперболы
начинающейся в точке V1,
p1
и
заканчивающейся в точке V2,
p2.
.
Так как T
= const,
давление в данном процессе обратно
пропорционально объёму, и линия,
изображающая данный процесс на p-V
диаграмме, будет участком гиперболы
начинающейся в точке V1,
p1
и
заканчивающейся в точке V2,
p2.
Второй процесс, происходящий с газом, является изохорическим. В этом процессе объём не изменяется и, следовательно, на P-V диаграмме он изображается в виде вертикальной прямой, идущей из точки V2, p2 в точку V2, p3.
Третий процесс происходящий с газом, по условию задачи, изобарический. На P-V диаграмме он будет выглядеть как горизонтальная линия, идущая из точки V2, p3 в точку V3, p3.
П оследовательно
изображая все процессы, получим
следующую P-V
диаграмму.
оследовательно
изображая все процессы, получим
следующую P-V
диаграмму.
Рассчитаем работу, совершенную газом. Так как работа, совершаемая газом, аддитивная величина
А = А1+А2+А3 ,
где А1 – работа, совершенная в изотермическом процессе,
А2 – работа, совершенная в изохорическом процессе,
А3
–
работа,
совершенная в изобарическом процессе.
Каждую из работ можно вычислить по
формуле
 (V1
и V2
– начальные
и конечные объёмы, занимаемые газом).
Применим эту формулу для определения
работы А1.
Согласно уравнению Менделеева –
Клапейрона, зависимость p(V)
имеет вид
(V1
и V2
– начальные
и конечные объёмы, занимаемые газом).
Применим эту формулу для определения
работы А1.
Согласно уравнению Менделеева –
Клапейрона, зависимость p(V)
имеет вид
![]() .
.
Следовательно,
работа
 .
Множитель
.
Множитель
![]() RT
вынесем из-под знака интеграла как
постоянную величину, заменяя её на p1V1,
получим
RT
вынесем из-под знака интеграла как
постоянную величину, заменяя её на p1V1,
получим
![]() .
.
В изохорическом процессе изменение объёма газа не происходит, следовательно, А2 = 0.
При вычислении работы А3 учтём, что давление, как постоянная величина, может быть вынесена из под знака интеграла
 .
.
Для
расчёта необходимо знать давление P3.
Так как первый процесс изотермический,
![]() .
По условию задачи
.
По условию задачи
![]() ,
следовательно,
,
следовательно,
![]() .
.
Общая работа А = А1+А2+А3 = 238,63 Дж.
В качестве дополнения заметим, что существует еще один способ определения работы, совершаемой газом, – графический. Как известно, площадь на диаграмме pV между линией, изображающей процессы, происходящие с газом, и осью объема по модулю равна работе. Если объём газа увеличится, то работа положительна, в противном случае отрицательна. В ряде случаев этот метод позволяет найти работу, не прибегая к вычислению интегралов.
Ответ: А = 238,63 Дж.
Задача 6
Определите показатель адиабаты
для смеси газов, содержащей гелий массой
![]() =
8 г и водород массой
=
8 г и водород массой
![]() =
2 г. Газы считать идеальными.
=
2 г. Газы считать идеальными.
|
Дано:
|
|
|
По
определению
![]() .
Рассчитаем удельные теплоёмкости для
смеси газов. Первой вычислим теплоёмкость
при постоянном объёме. Количество
теплоты, необходимое для нагревания
смеси газов на ΔT,
с одной стороны, по определению
теплоёмкости, равно
.
Рассчитаем удельные теплоёмкости для
смеси газов. Первой вычислим теплоёмкость
при постоянном объёме. Количество
теплоты, необходимое для нагревания
смеси газов на ΔT,
с одной стороны, по определению
теплоёмкости, равно
![]() .
.
С другой стороны, данное количество теплоты может быть представлено как сумма теплот, идущих на нагревание двух газов по отдельности:
![]() .
.
Приравнивая
выражения, получим
 .
.
Удельные теплоёмкости газов можно выразить через число степеней свободы молекул и молярные массы газов:
![]() ;
;
![]() ,
,
где
![]() = 3,
= 3,
![]() = 5.
= 5.
После
подстановки получаем
 .
.
Аналогичные рассуждения дадут для удельной теплоёмкости при постоянном давлении
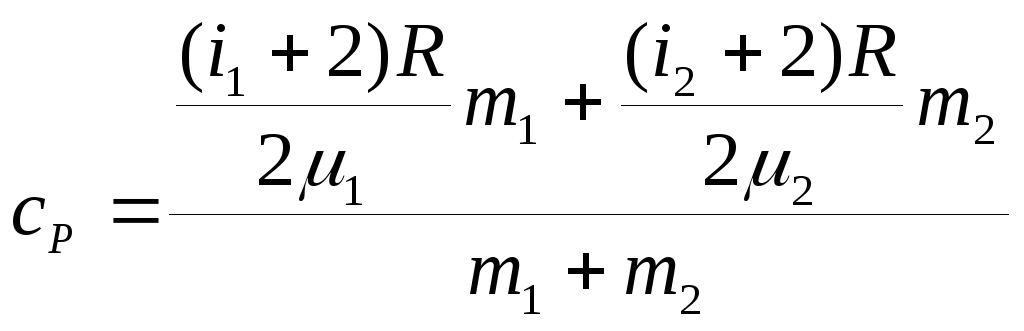 .
.
Соответственно показатель адиабаты после подстановки полученных выражений
 .
.
Ответ:
![]() .
.
Задача 7 Определить КПД тепловой машины, работающей по циклу, изображенному на рисунке, если известно, что V2 = 2V1, Т2 = 2Т1, а рабочим телом является идеальный трехатомный газ.
|
Дано: Т2 = 2Т1 V2 = 2V1 |
|
|
Прежде всего проанализируем процессы, происходящие с газом. Процессы 2 – 3 и 4 – 1, как видно из рисунка, являются изохорическими. В процессах 1 – 2 и 3 – 4 температура прямо пропорциональна объёму. Значит, данные процессы являются изобарическими.
П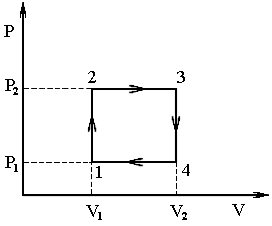 ерерисуем
цикл машины в координатах p–V.
По условию задачи температуры в начале
и конце изохорического процесса
отличаются в 2 раза. Значит, во столько
же раз должны отличаться давления газа
и можно записать, что
ерерисуем
цикл машины в координатах p–V.
По условию задачи температуры в начале
и конце изохорического процесса
отличаются в 2 раза. Значит, во столько
же раз должны отличаться давления газа
и можно записать, что
p2 = 2p1.
КПД
цикла, по определению, равен отношению
работы, совершенной газом, к количеству
теплоты, полученной от нагревателя:
![]() .
.
Работа, совершаемая газом за цикл, численно равна площади, ограничиваемой циклом на диаграмме p-V. В данном случае эта площадь представляет собой прямоугольник, следовательно:
A = (p2 - p1)(V2 - V1) = p1V1.
Тело получает теплоту от нагревателя на участках 1-2 и 2-3 (на участках 3-4 и 4-1 рабочее тело тепловой машины отдаёт теплоту холодильнику): Qн = Q12 + Q34.
Рассчитаем
количество теплоты Q12
=
![]() СV(T2
-
T1).
СV
=
3R
молярная теплоемкость трёхатомного
газа при постоянном объёме. Учтем, что
для трёхатомного газа число степеней
свободы i
= 6. Т1
и Т2
температуры
в соответствующих точках цикла. Раскрывая
скобки и учитывая, что
СV(T2
-
T1).
СV
=
3R
молярная теплоемкость трёхатомного
газа при постоянном объёме. Учтем, что
для трёхатомного газа число степеней
свободы i
= 6. Т1
и Т2
температуры
в соответствующих точках цикла. Раскрывая
скобки и учитывая, что
![]() RT1
= p1V1;
RT1
= p1V1;
![]() RT2
= p2V1
=
2p1V1,
получим
RT2
= p2V1
=
2p1V1,
получим
Q12
=
3R![]() (T2-T1)
= 3 (
(T2-T1)
= 3 (![]() RT2-
RT2-
![]() RT1)
= 3(2p1V1
- p1V1)
=3 p1V1.
RT1)
= 3(2p1V1
- p1V1)
=3 p1V1.
Аналогично,
можно записать Q23
=
![]() Сp(T3-T2).
Ср
=
4R
– молярная теплоёмкость трёхатомного
идеального газа при постоянном объёме.
Учитывая, что
Сp(T3-T2).
Ср
=
4R
– молярная теплоёмкость трёхатомного
идеального газа при постоянном объёме.
Учитывая, что
![]() RT3
= p2V2
= 4p1V1,
RT3
= p2V2
= 4p1V1,
запишем
Q23
=
4R![]() (T3-T2)
= 4(4p1V1
–
2p1V1)
= 8p1V1,
QН
=
Q12
+
Q23
=
11 p1V1.
(T3-T2)
= 4(4p1V1
–
2p1V1)
= 8p1V1,
QН
=
Q12
+
Q23
=
11 p1V1.
Рассчитаем
коэффициент полезного действия
![]() .
.
Ответ:
![]() .
.
Задача 8
В двух сосудах одного и того же объёма
находится гелий массой 10 г (![]() 1=
4·10-3
кг/моль)
и азот массой 56 г (
1=
4·10-3
кг/моль)
и азот массой 56 г (![]() 2
=
28·10-3
кг/моль). Давление и температура газов
одинаковы. Сосуды соединяют и начинается
процесс диффузии. Определить изменение
энтропии системы в данном процессе.
2
=
28·10-3
кг/моль). Давление и температура газов
одинаковы. Сосуды соединяют и начинается
процесс диффузии. Определить изменение
энтропии системы в данном процессе.
|
Дано: m1 = 10 г =0,01 кг
m2 = 56 г = 0,056 кг
|
|
ΔS -? |
Процесс диффузии в данной задаче можно рассматривать как процесс изотермического расширения. В этом случае изменение энтропии гелия
![]() .
.
Так как процесс изотермический, Q1 = A1. Вычисляя работу в изотермическом процессе, получим
 .
.
В
последней формуле учтено, что V2
= 2V1,
так как
по
условию объёмы обоих сосудов равны.
Следовательно,
![]() .
.
Аналогичные
вычисления для второго газа дают
![]() .
.
Полное изменение энтропии всей системы
![]() .
.
Ответ:
![]() .
.
