
МЕТОДИЧКИ / Методички (мол) / №38
.docxЛабораторная работа №38
ОПРЕДЕЛЕНИЕ ТЕРМИЧЕСКОГО КОЭФФИЦИЕНТА ДАВЛЕНИЯ ВОЗДУХА.

Принадлежности: установка (газовый термометр), водоподогреватель «Термекс».
Цель работы:
1. Познакомиться с работой газового термометра.
2. Экспериментально определить термический коэффициент давления воздуха.
Введение. Некоторое количество газа характеризуется пятью величинами: массой m,объемом V, давлением Р, температурой Т и молекулярным весом µ.
Эти величины закономерно связаны друг с другом. Связь между ними называется уравнением состояния. В случае идеальных газов уравнение состояния, называемое уравнением Клапейрона-Менделеева, имеет вид
 V=
V= (1)
(1)
Где R-универсальная газовая постоянная.
Уравнение (1) характеризует любое состояние газа, например, первое состояние
 1V1=
1V1= 1
(2)
1
(2)
Для той же массы газа во втором состоянии
 2V2=
2V2= 2
(3)
2
(3)
Разделив (2) на (3), получаем формулу, которую часто называют объединенным газовым законом:

Известные экспериментальные газовые законы Бойля-Мариотта, Гей-Люссака и Шарля могут рассматриваться как следствия уравнения Клапейрона-Менделеева, когда газ переходит из одного состояния в другое так, таким образом, что один из его параметров не меняется.
Рассмотрим изохорический процесс, процесс при котором газ переходит из первого состояния во второе и объем его при этом не меняется V1=V2= соnst. Кроме того, начальную температуру газа возьмем Т1=Т0=2730К. Для первого состояния уравнение (1) запишется так
 0V1=
0V1= 0,
(4)
0,
(4)
Где Р0- давление, соответствующее температуре 2730К.
Пусть температура этого газа меняется от Т0до Т, тогда давление будет меняться от Р0 до Р. Объем газа остается неизменным( по условию). Для второго состояния этого газа уравнение Клапейрона-Менделеева будет иметь вид
 V1=
V1= ,
(5)
,
(5)
Разделив (4) на (5), получим

Введем обозначение

Тогда Р=Р0 α∙Т (6)
Уравнение (6) называется законом Шарля.
Величину α называют термическим коэффициентом давления газа
 .
.
Коэффициент термического давления есть число, которое показывает на какую часть меняется первоначальное давление газа, взятого при нуле градусов Цельсия, при изменении температуры на один градус, если объем газа не меняется.
Формула закона Шарля (3) будет иметь другой вид, если температуру отсчитывать не по шкале Кельвина, а по шкале Цельсия. Действительно, подставив (6) Т= t+2730получаем
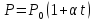 (7)
(7)
Как показывает опыт, все реальные газы, в состоянии далеком от насыщения, почти полностью подчиняются законам для идеальных газов. В данной работе ставится задача - определить экспериментально термический коэффициент давления воздуха α при помощи газового термометра.
Практически коэффициент α можно определить путем измерения двух любых температур t1 и t2 и соответствующих им давлений газа Р1 и Р2 при неизменном объеме. Из закона Шарля
 1
cостояние
1
cостояние
 2
состояние
2
состояние
Получим
 .
(8)
.
(8)
Формула (8) является расчетной для нашего опыта.
Описание прибора. Общий вид экспериментальной установки избражен на рис .1. Установка (рис.2. и рис.3.) состоит из стеклянного баллона 1, заполненного воздухом, водяного манометра 15, измерителя температур 4 и водоподогревателя (на рисунке не изображен). Стеклянный баллон с воздухом 1 помещен в металлический сосуд-термостат 3. Термостат заполняется циркулирующей через него водой от водоподогревателя при помощи насоса. Двухканальный измеритель температур 4 ТРМ-200, подключенный к двум хромель-копелевым термопарам 2, предназначен для измерения температуры воздуха в баллоне с воздухом и температуры воздуха в комнате. Водяной манометр предназначен для измерения давления нагретого газа в баллоне. Давление нагретого газа равно сумме атмосферного давления, которое отсчитывается по лабораторному барометру, и давления, отсчитываемого по водяному манометру установки. Отсчет уровней водяного манометра производится по положению менисков относительно миллиметровой шкалы 7. При необходимости выравнивание давления внутри баллона до атмосферного давления производится открытием крана 5 трубки.
Измерения.
Внимание! Перед выполнением работы тщательно ознакомьтесь с порядком работы. Заранее подготовьте таблицу. Конструктивные особенности лабораторной установки не позволяют быстро охладить воздух в баллоне. ИЗМЕРЕНИЯ МОЖНО ПРОВЕСТИ ТОЛЬКО ОДИН РАЗ ЗА ЗАНЯТИЕ!
-
Включить тумблером 8 питание установки.
-
Включить тумблером 9 насос водоподогревателя. В течении 5 минут термостат наполнится циркулирующей через него водой.
-
Включить измеритель температур 4 тумблером 1. Температура внутри баллона с воздухом отображается индикатором с красными цифрами, комнатная температура – индикатором с зелеными цифрами. Измерение комнатной температуры в данной работе не используется. Записать в таблицу температуру воздуха Т (всегда записывать красные цифры).
-
Тщательно по нижним точкам менисков уровня жидкости отсчитать величины положения уровней жидкости
 в
правом колене манометра и Һ2
– в
левом
колене (уровни жидкости должны быть на
одинаковой отметке шкалы 7). Если уровни
жидкости находятся на разных отметках
шкалы, то необходимо повернуть ручку
крана 5 в положение «ОТКРЫТО». При этом
уровни
в
правом колене манометра и Һ2
– в
левом
колене (уровни жидкости должны быть на
одинаковой отметке шкалы 7). Если уровни
жидкости находятся на разных отметках
шкалы, то необходимо повернуть ручку
крана 5 в положение «ОТКРЫТО». При этом
уровни
 в
правом и Һ2
в левом колене манометра должны
сравняться.
в
правом и Һ2
в левом колене манометра должны
сравняться. -
По лабораторному барометру определить и записать над таблицей 1 атмосферное давление Ратм (в Паскалях)..
-
Повернуть ручку крана 5 в положение «ЗАКРЫТО».
-
Тумблером 10 включить питание водоподогревателя. ПОСЛЕ ВКЛЮЧЕНИЯ ПИТАНИЯ ОСТАНОВКА ИЛИ ПОВТОРНОЕ ПРОВЕДЕНИЕ ЭКСПЕРИМЕНТА НЕВОЗМОЖНЫ В ТЕЧЕНИЕ НЕСКОЛЬКИХ ЧАСОВ! На передней панели водоподогревателя расположен регулятор режимов. Повернуть ручку регулятора на «девятую» точку. Не следует изменять режимы нагрева! После включения питания водоподогревателя вода, циркулирующая в сосуде-термостате, будет нагреваться, и температура воздуха в баллоне будет медленно увеличиваться.
-
Производить измерения уровней воды в манометре
 и Һ2
при увеличении температуры на каждые
0,5 градуса, до максимально возможного
значения разности уровней (
и Һ2
при увеличении температуры на каждые
0,5 градуса, до максимально возможного
значения разности уровней ( не
ниже 12 см,
Һ2
не выше 25 см). Результаты измерений
записывать в таблицу 1.
не
ниже 12 см,
Һ2
не выше 25 см). Результаты измерений
записывать в таблицу 1. -
По окончании работы открыть кран 5, выключить измеритель температур, отключить насос водоподогревателя 9, отключить питание установки.
Обработка результатов измерений
-
Для каждой температуры T рассчитать перепад давлений ΔР=ρg(h2-h1), где ρ= 1000 кг/м3 – плотность воды в манометре, g=9,81 м/с2 – ускорение свободного падения, h2 и h1 измеряются в метрах.
-
Далее рассчитать давление нагретого воздуха в баллоне по формуле Р=Ратм+ΔР.
-
Построить график зависимости давления нагретого газа Р (в Паскалях) от температуры T (в градусах Цельсия) в виде прямой линии. На миллиметровой бумаге в выбранном масштабе по горизонтальной оси температура, а по вертикальной – давление газа. Экспериментальные точки на графике могут иметь некоторый разброс из-за погрешности измерений. Линия графика проводится так, чтобы точки располагались выше и ниже проводимого графика примерно в равном количестве. Некоторые точки могут оказаться на самой линии.
-
Пользуясь полученным графиком, находят два значения давления Р1 и Р2, соответствующие двум выбранным значениям температуры T1 и T2. Данные записать в таблицу 2. Вычислить термический коэффициент давления воздуха α. Сравнить с табличным значением α=0,00366

Таблица 1
Ратм=
|
№ |
T0,С |
h1,мм |
h2,мм |
h2-h1, м |
ΔР, Па |
Р, Па |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Таблица 2
|
1 точка на графике |
2 точка на графике |
|
|
Разность
|
Разность
|
Температурный
коэффициент
|
|
T1= |
T2= |
|
|
|
|
|
|
Р1= |
Р2= |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Контрольные вопросы
-
Перечислите все изопроцессы. Сформулируйте газовые законы для всех изопроцессов и запишите соответствующие уравнения.
-
Какой процесс наблюдается в данной работе?
-
Дайте определение термического коэффициента давления.
-
Что называют идеальным газом? Запишите уравнение состояния идеального газа.
-
Что называют давлением газа? Единицы измерения давления газа. Давление Р=560 мм рт.ст. Чему равно Р в паскалях, физических атмосферах, барах?
-
Дайте определение температуры. Дайте определение температурных шкал Кельвина и Цельсия.
-
Какие типы термометров применяются для измерения температуры? Назовите преимущества газового термометра.
Список рекомендуемой литературы
1. Сивухин Д.В. Общий курс физики. Т 2. Термодинамика и молекулярная физика. М.: Физматлит, 2006.
2. Савельев И.В. Курс общей физики. Т.1. Механика и молекулярная физика. СПб.: Лань, 2005.
3. Трофимова Т.И. Курс физики. М.: Академия, 2006.
Какие факторы влияют на точность результата, получаемого в данной работе?





