
- •Пермский государственный технический университет
- •Введение
- •Список литературы
- •1. Краткие методически указания по
- •2. Методические указания к решению задач
- •3. О приближенных вычислениях
- •4. Основные формулы
- •Колебания и волны
- •Динамика
- •4.1. Примеры решения задач
- •4.2. Тренировочные задачи
- •4.3. Проверочный тест
- •1) Б, в и г; 2) б и в; 3) а и д; 4) а, г и д; 5) от всех этих факторов.
- •1) Моменты всех сил относительно оси оо' равны нулю
- •1) Увеличится в 2 раза; 2) увеличится в 4 раза; 3) увеличится в раз;
- •4) Уменьшится раз; 5) уменьшится в 2 раза.
- •4) Увеличится в раз; 5) уменьшится в 2 раза.
- •1) Только а и в; 2) только с; 3) только с и d; 4) в, с и d; 5) а, в, с и d.
- •1) Скорость равна /t; 2) амплитуда равна 2а; 3) скорость направлена вдоль отрицательной оси X; 4) период равен t/; 5) скорость равна X/t;
- •4.4. Контрольная работа №1
- •5. Основные формулы Молекулярная физика. Термодинамика
- •5.1. Примеры решения задач
- •5.2. Тренировочные задачи
- •5.3. Контрольная работа № 2.
- •6. Вопросы для подготовки к экзамену
- •7. Справочные таблицы
- •7.4. Удельная теплота испарения воды при разных температурах
- •7.5. Свойства некоторых жидкостей
- •7.6. Относительные атомные массы
- •7.7. Множители и приставки для образования
5. Основные формулы Молекулярная физика. Термодинамика
Моль – количество вещества (молекул) масса которого в граммах
численно равна массе молекулы m0 в атомных единицах массы (1 а.е.м. равна 1/12 массы атома углерода 6С12).
2. Количество вещества тела (системы) в молях
ν = N / NA = m/μ,
где N – число структурных элементов (молекул, атомов, ионов и т.п.), составляющих тело (систему); NА – постоянная Авогадро (NА = 6,02∙1023 моль-1); μ – масса моля вещества.
3. Количество вещества смеси газов
ν = ν1 + ν2 +…+ νn = N1/NA + N2/NA + … + Nn/NA ,
или
![]() ,
,
где νi, Ni, mi, μi – соответственно количество вещества, число молекул, масса, молярная масса i – го компонента смеси.
4. Уравнение Менделеева - Клапейрона (уравнение состояния идеального газа)
![]() ,
,
где m – масса газа, μ –молярная масса газа, R – молярная газовая постоянная, ν – количество вещества, Т – термодинамическая температура.
5. Опытные газовые законы, являющиеся частными случаями уравнения Менделеева – Клапейрона для изопроцессов:
а) закон Бойля-Мариотта (изотермический процесс: Т = const, m = const)
pV = const,
или для двух состояний газа
p1V1 = p2V2,
б) закон Гей-Люссака (изобарный процесс: р = const, m = const)
![]() ,
,
или для двух состояний
![]() ;
;
в) закон Шарля (изохорный процесс: V = const, m = const)
![]() ,
,
или для двух состояний
![]() ;
;
г) объединенный газовый закон (m = сonst)
![]() ,
,
где p1, V1, T1 – соответственно давление, объем и температура газа в начальном состоянии; p2, V2, T2 – те же величины в конечном состоянии.
6. Закон Дальтона, определяющий давление смеси газов
р = р1 + р2 +…+ рn,
где рi – парциальные давления компонентов смеси; n – число компонентов смеси.
Парциальным давлением называется давление газа, которое производил бы газ, если бы только он один находился в сосуде, занятом смесью при температуре смеси.
Молярная масса смеси газов
![]() ,
,
где m1 – масса i –го компонента смеси; νi – количество вещества i –го компонента смеси; n – число компонентов смеси.
Массовая доля i-го компонента смеси газа (в долях единицы или процентах)
![]() ,
,
где m – масса смеси.
7. Концентрация молекул
![]() ,
,
где N – число молекул, содержащихся в данной системе, ρ – плотность вещества, V – объем системы. Формула справедлива не только для газов, но и для любого агрегатного состояния вещества.
8. Основное уравнение кинетической теории газов
![]() р
= 2/3n<εп>,
р
= 2/3n<εп>,
где <εп> - средняя кинетическая энергия поступательного движения молекулы.
9. Зависимость давления газа от концентрации молекул и температуры
p = nkT.
10. Скорости молекул:
<vкв>
=
![]() – средняя квадратичная;
– средняя квадратичная;
<v>
=
![]() – средняя арифметическая;
– средняя арифметическая;
v
=
![]() –
наиболее вероятная,
–
наиболее вероятная,
где m1 – масса одной молекулы.
11. Средняя кинетическая энергия поступательного движения молекулы
<εп> = 3/2 kT,
где k – постоянная Больцмана.
Полная средняя кинетическая энергия молекулы
<εi>
=
![]() ,
,
где i – число степеней свободы молекулы.
12. Внутренняя энергия идеального газа
![]() .
.
13.
Теплоемкость тела
![]() .
.
Удельная
теплоемкость
![]() .
.
Молярная
теплоемкость
![]() .
.
14. Удельные теплоемкости газа при постоянном объеме (сv) и постоянном давлении (ср)
![]() .
.
Связь между удельной и молярной С теплоемкостями
с = С/μ, С = сμ.
Уравнение Майера
Ср –Сv = R.
15. Работа расширения газа:
 в
общем случае;
в
общем случае;
А = р(V2 – V1) при изобарном процессе;
![]() при
изотермическом процессе.
при
изотермическом процессе.
16. Первое начало термодинамики
Q = ΔU + A,
где Q – теплота, сообщенная системе (газу); ΔU – изменение внутренней энергии системы; А – работа, совершенная системой против внешних сил.
17. Адиабатный процесс – процесс в теплоизолированной системе (ΣQi = 0). Уравнения Пуассона, связывающие параметры идеального газа при адиабатном процессе:
pVγ
= const,
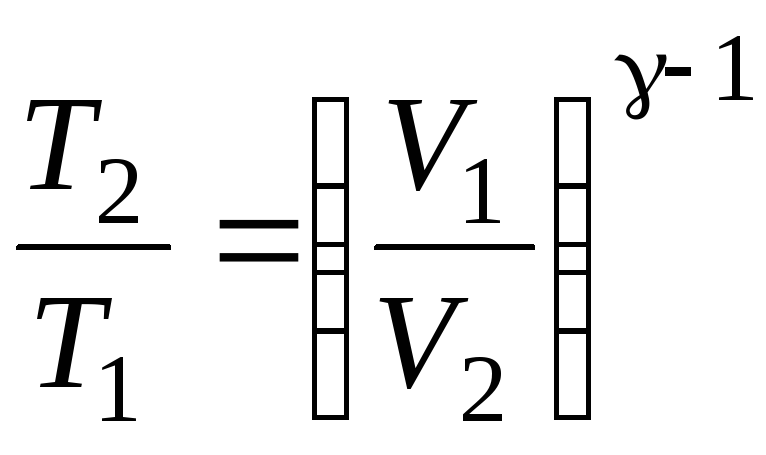 .
.
 ;
;
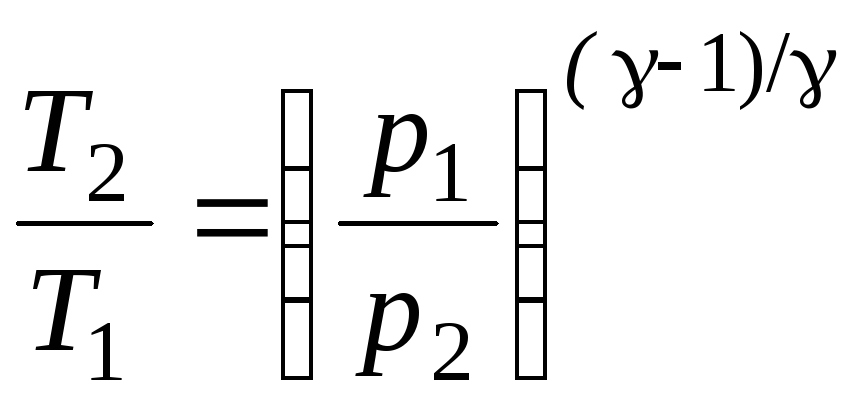 .
.
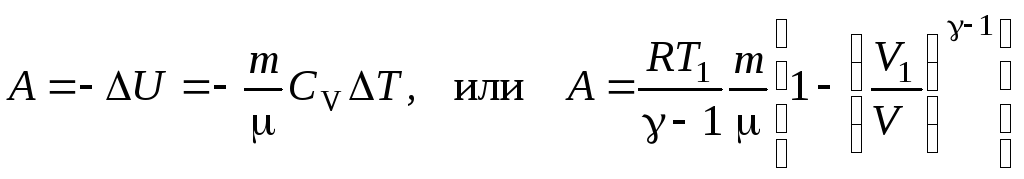 ,
,
где γ = ср/cV – показатель адиабаты.
18. Термический КПД цикла
![]() ,
,
где Q1 – теплота, полученная рабочим телом от теплоисточника; Q2 –теплота, переданная рабочим телом теплоприемнику.
19. Термический КПД цикла Карно (имеет наибольший КПД)
![]() ,
,
где Т1 и Т2 – термодинамические температуры нагревателя и холодильника.
20. Изменение энтропии при переходе из состояния 1 в состояние 2
![]() .
.
