- •1.Основные положения молекулярно-кинетической теории.Макроскоп.Системы
- •2. Функция состояния.Температура.Внутр.Энергия
- •3. Идеальный газ.Газовые законы.З-ны Дальтона и Авогадро
- •4.Ур-е состояния идеального г. Постоянные Больцмана и Лошмидта
- •6.Положение Максвела о распередел.Молекул идельнг газа по энергиям
- •7.Вероятная скорость движ.Молекул.Зависимость распределения Максвела от т
- •12.З-н Больцмана о равномерном распеределении энергии по степеням свободы.Внутр э г.
- •13.Первое начало термодинамики.Работа и теплота
- •18.А в цикле Карно.Теплический кпд
- •19.Энтропия.Изменение энтропии в изопроцесах
- •21.Статистическое толкование энтропии. 3ее начало термодинамики
- •24.Уравнение состояния реального газа.Изотермы Ван-дер-Ваальса
12.З-н Больцмана о равномерном распеределении энергии по степеням свободы.Внутр э г.
1) Закон Больцмана о равномерном распределении энергии по степеням свободы молекул: для статистической системы, которая находится в состоянии термодинамического равновесия, на каждую поступательную и вращательную степени свободы приходится в среднем кинетическая энергия, равная kT/2, а на каждую колебательную степень свободы — в среднем энергия, равная kT.
Ē0=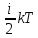 ,
где
i
— сумма числа поступательных, числа
вращательных и удвоенного числа
колебательных степеней свободы молекулы:
i=iпост+iвращ+2iколеб.
,
где
i
— сумма числа поступательных, числа
вращательных и удвоенного числа
колебательных степеней свободы молекулы:
i=iпост+iвращ+2iколеб.
2) Внутренняя энергия для одного моля газа, будет равна сумме кинетических энергий NA молекул:
Um=
 a=
a=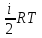
Внутренняя энергия для произвольной массы m газа.
U=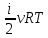
13.Первое начало термодинамики.Работа и теплота
1)
ПЕРВОЕ
НАЧАЛО ТЕРМОДИНАМИКИ - закон сохранения
энергии для термодинамич. системы,
согласно к-рому работа может совершаться
только за счёт теплоты или какой-л. др.
формы энергии.
![]()
2) А-работа-это энергия, передаваемая в термодинамическую систему внешними силами.
3) ТЕПЛОТА- кинетическая часть внутренней энергии вещества, определяемая интенсивным хаотическим движением молекул и атомов, из которых это вещество состоит.
4)
работа
газа при изменении объема
![]()
14.Теплоемкость идеального газа.Опеределение т.идеалн.газа.Уравнение Майера
1)
Теплоемкость- величина, определяемая
количеством теплоты, которую необходимо
сообщить системе, чтобы повысить его t
на 1ºK.
С=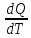 [
[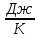 ]
]
2)
Сv=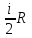 ,
V=const
,
V=const
3)Cp=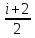 R
,p=const
R
,p=const
4)
МАЙЕРА
УРАВНЕНИЕ - ур-ние, устанавливающее
связь между теплоёмкостями при пост,
давлении Cp и пост, объёме СV 1 кмоля
идеального газа:
![]()
U=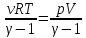
Показатель
адиабаты γ=
15. Применение 1ого начала термодинамики к изопроцессам
1) Применение первого начала термодинамики к изопроцессам
1.
Изохорный процесс (V=const)
Q=ΔU+A,
A=0,
ΔU=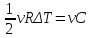 vΔT,
Сv=
vΔT,
Сv=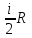
2.
Изобарный
процесс (p=const)
Q=ΔU+A,
A=pdV=p(V2-V1)
–
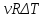 =
=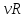 (V2-V1)
(V2-V1)
физический смысл молярной газовой постоянной R:. R численно равна работе изобарного расширения 1 моль идеального газа при нагревании его на 1 К.
ΔU=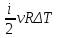 =νCvΔT,
Q=νCpΔT
=νCvΔT,
Q=νCpΔT
3.
Изотермический
процесс (T=const)
Q=ΔU+A,
ΔU=0,
A=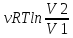
16.Адиабатный процесс.уранение Пуассона
1) Адиабатный процесс (Q=0)- процесс, при котором отсутствует теплообмен между системой и окружающей средой. ΔU= -A , A=νCv(T2-T1)
2) Политропный процесс- процесс, в котором теплоемкость системы остается постоянной.
A=-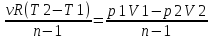 ,n=
,n= ,
Сn=
,
Сn=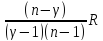 Еслиn=γ
Cn=0,
n=1
Cn→
беск-ть, 1<n<γ
Еслиn=γ
Cn=0,
n=1
Cn→
беск-ть, 1<n<γ
17.Круговой процесс.Необратимые и обратим.процес.КПД.Тепловые машины
1) Круговой процесс-это процесс, при котором система, пройдя через ряд состояний, возвращается в исходное состояние.
Прямой цилк (протекает по часовой стрелке) A>0(Двигатели).
Обратный цилк (против часовой стрелки) А<0 (холодильники)
2) Процесс наз. обратимым, если он допускает возвращение рассматриваемой системы из конечного состояния в исходное через ту же последовательность промежут. состояний, что и в прямом процессе, но проходимую в обратном порядке. При этом в исходное состояние возвращается не только система, но и среда. Обратимый процесс возможен, если и в системе, и в окружающей среде он протекает равновесно. Если невозможно найти способ вернуть и систему, и тела в окружающей среде в исходное состояние, процесс изменения состояния системы наз. необратимым. Необратимые процессы могут протекать самопроизвольно только в одном направлении; таковы диффузия, теплопроводность, вязкое течение и др.
3)
КПД η=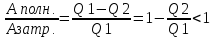
КПД
холодильника η=