
Лекции ХТОВ 1 / Получение окиси пропилена / Лекция Эпоксидирование пропилена+
.docЭпоксидирование пропилена
Окись пропилена является одним из крупнотоннажных продуктов органического синтеза. Мировое производство ежегодно возрастает. Стимулом такого роста является расширение применении этих веществ в производстве растворителей, пластиков, смачивающих и взрывчатых веществ и антифризов, а также прежде всего для получения пропиленгликоля, полиэфиров и полиуретанов.
Теоретические основы процесса
Ранее указывалось, что гетерогенно-каталитическое эпоксидирование олефинов дает положительный результат только для этилена, а у его гомологов происходит окисление более реакционно-способного атома углерода в аллильном положении (синтез акролеина и др.). При радикально-цепном окислении гомологов этилена, аналогичном реакции с парафинами, затрагиваются атомы углерода как в аллильном положении, так и при двойной связи. При этом образуются сложные смеси продуктов. Поэтому для эпоксидирования гомологов этилена используют не молекулярный кислород, а пероксидные соединения.
Первым достаточно селективным и общим методом эпоксидирования олефинов была реакция Прилежаева, состоящая во взаимодействии олефинов с пероксикислотами, прежде всего с наиболее доступной из них перуксусной кислотой. Считается, что пероксикислота реагирует в циклической форме с внутримолекулярной водородной связью, когда на пероксидном атоме кислорода появляется частичный положительный заряд, обеспечивающий возможность электрофильной атаки двойной связи:
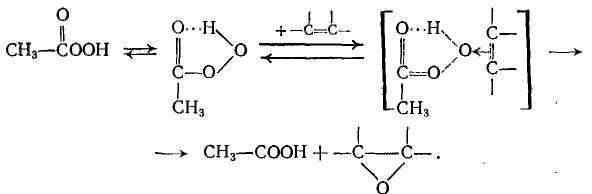
До последнего времени эпоксидирование перуксусной кислотой применяли лишь в тонком органическом синтезе, но имеется и промышленная установка синтеза пропиленоксида из пропилена и перуксусной кислоты.
Использование органических гидропероксидов для синтеза α-оксидов долго не давало хороших результатов, и лишь в начале 60-х годов их удалось достичь при использовании металлокомплексного катализатора в жидкой фазе:
![]()
Катализаторы и механизм
Катализаторами реакции являются соли и различные комплексы (ацетилацетонаты, карбонилы) молибдена, вольфрама, ванадия, титана, ниобия и других переходных металлов, растворимых в реакционной массе. Скорость и селективность реакции сильно зависят от природы металла и формы, в которой он применяется. Ниже это проиллюстрировано на примере реакции гидропероксида этилбензола с пропиленом (при 100°С, 1 ч) при катализе нафтенатами металлов:

Промышленное применение получил нафтенат молибдена, при работе с которым скорость и селективность процесса являются достаточно высокими, и другие соединения молибдена.
Природа гидропероксида также оказывает большое влияние на эти показатели процесса. Выбор гидропероксида диктуется, не только факторами селективности и конверсии, но также практическим значением второго продукта — спирта, который можно дегидратацией превратить в соответствующий олефин. По совокупности всех причин практическое значение получили главным образом гидропероксиды этилбензола и изобутана.
Важное значение имеет строение ненасыщенного соединения, причем повышению его реакционной способности способствует наличие электронодонорных заместителей. Легко эпоксидируются пропилен, другие гомологи этилена и стирол, труднее — этилен и особенно аллилхлорид.
Считают, что роль катализатора состоит в активировании молекулы гидропероксида, которая координируется по своему кислородному атому с центральным ионом металла, находящимся в одном из высших валентных состояний (Мо6+ и др.). Олефин реагирует с образовавшимся комплексом, уже координированным с гидропероксидом:
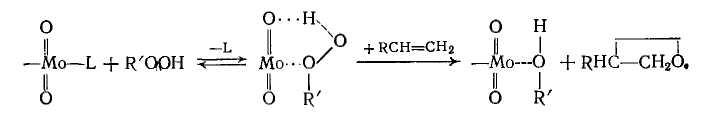
Побочные реакции:
С6H5–СН–СН3+ СН2=СН–СН3→ С6H5–СН–СН3+ СН3–СН–СНО
| |
О–ОН ОН
ГПЭБ пропилен МФК пропионовый
альдегид
С6 H5–СН–СН3+ СН3=СН–СН3→ С6H5–СН–СН3 + СН3–С–СН3
| | | |
О–ОН ОН О
ГПЭБ пропилен МФК ацетон
С6H5–СН–СН3+ 2/3СН2=СН–СН3→ С6H5–СН–СН3+ СН3–СНО
| |
О–ОН ОН
ГПЭБ пропилен МФК ацетальдегид
С6H5–СН–СН3
→ С6H5–СН–СН3
+ 0,5 О![]()
| |
О–ОН ОН
ГПЭБ МФК кислород
С6 H5 СН–СН3→ С6 H5 - С-СН3 + Н2 О
| ||
О–ОН О
ГПЭБ ацетофенон вода
С6H 5–СН–СН3 → С6H5–ОН + СН5–СНО
|
О–ОН
ГПЭБ фенол ацетальдегид
Поскольку основной побочной реакцией является параллельное разложение гидропероксида (ROOH->-ROH+0,5O2), также протекающее на катализаторе, повышению селективности способствуют высокая концентрация ненасыщенного соединения (для чего при реакции с газообразными олефинами требуется высокое давление) и умеренная температура (поскольку энергия активации при эпоксидировании меньше, чем для разложения гидропероксида). Селективность всегда выше при использовании гидропероксидов, более стойких к разложению. В отличие от годропероксидов, селективность процесса по олефину всегда высокая и близка к 100 %.
Технологические основы процесса
Рассмотренные закономерности реакции обусловили выбор условий для ее проведения. Процесс осуществляют в жидкой фазе (обычно в растворе того углеводорода, из которого был получен гидропероксид), при 90—110°С и 2—5-кратном избытке олефина по отношению к гидропероксиду. В зависимости от летучести углеводорода-растворителя и олефина для поддержания реакционной массы в жидком состоянии может потребоваться давление до 5—7 МПа. В этих условиях реакция имеет достаточно высокую скорость при концентрации катализатора 0,001— 0,005 моль на 1 моль гидропероксида, что позволяет не проводить его регенерацию. В зависимости от температуры, концентрации катализатора и природы исходных реагентов время реакции изменяется от 0,3 до 2 ч.
При реакции гидропероксидов с олефинами образуются два главных продукта — а-оксид и спирт, который можно дегидратировать в соответствующий олефин, поэтому все процессы такого типа являются комбинированными и включают, как правило, следующие три стадии:
1. Окисление этилбензола или изобутана
2. Эпоксидирование пропилена
3. Дегидратация соответствующего спирта
Эта комбинация реакций получила наименование Халкон-процесса по названию фирмы, которая впервые его разработала.
Технология совместного синтеза пропиленоксида и стирола (или пропиленоксида и изобутена). Главное применение Халкон-процесс нашел для получения пропиленоксида, о свойствах, применении и хлорном методе синтеза которого уже говорилось (глава 3). Ввиду большого расхода хлора и щелочи и образования отходов солей при хлорном методе давно велись поиски окислительного процесса, который позволил бы осуществить прямое эпоксидирование пропилена.
Из всех окислительных превращений наибольший успех выпал на долю Халкон-процесса. Он реализован в промышленности в двух вариантах: стирольном и изобутеновом. В первом случае сырьем являются этилбензол и пропилен, которые при участии кислорода превращаются в пропиленоксид и стирол:

Во втором процессе при аналогичных превращениях изобутана и пропилена образуются изобутен и пропиленоксид, причем в обоих случаях попутно с а-оксидом получается один из ценных мономеров — стирол или изобутен. Выбор стирольного или изо-бутенового варианта зависит от потребности в соответствующих олефинах.
Теоретические основы процесса
Селективность превращения пропилена в а-оксид достигает 95—97 %• Селективность по гидропероксиду на стадиях его синтеза и эпоксидирования составляет 80—85%, но благодаря полезному использованию побочных продуктов окисления этилбен-зола и разложения гидропероксида (метилфенилкарбинол и аце-тофенон) выход стирола достигает 90 % по этилбензолу. При этом на 1 т пропиленоксида получается 2,6—2,7 т стирола.
Отдувки пропилена


ГПЭБ




Пропилен
Эпоксидат
КМК






Рис. 1 Схема материальных потоков
