
Федеральное агентство по образованию
Государственное образовательное учреждение
высшего профессионального образования
Нижегородский Государственный Технический Университет им. Р.Е.Алексеева
Выксунский филиал
Кафедра общеобразовательных и общепрофессиональных дисциплин
Методическое пособие к выполнению
Лабораторной работы 1-8
Лабораторная работа 1-8
«Исследование теплоёмкости твёрдых тел»
Для студентов всех специальностей и всех форм обучения ВФ НГТУ
г. Выкса
2009г.
Составители: В.П. Маслов, О.Д. Честнова, С.А.Ковыляев
Определение теплоёмкости твёрдых тел с помощью экспериментальной установки ФПТ1-8: методическое пособие к выполнению лаб. работы № 1-8 по дисциплине «Физика» для студентов всех специальностей и всех форм обучения ВФ НГТУ; сост.: В.П.Маслов и др. г.Н.Новгород, 2009. -10 с.
Дана методика определения теплоёмкости образцов методом электрического нагрева с помощью экспериментальной установки ФПТ1-8. При написании использованы описания лабораторных работ НГТУ, МАИ, МИФИ, СФТИ и др. вузов.
Научный редактор А.А. Радионов
Редактор Э.Б. Абросимова
Подписано в печать Формат 60х48 1/16. Бумага газетная.
Печать офсетная. Усл. п. л. 0,75. Уч.-изд. л. 0,75. Тираж 200 экз. Заказ 14.
Нижегородский Государственный Технический Университет им. Р.Е.Алексеева
Типография НГТУ. 603950, ГСП-41, г. Нижний Новгород, ул. Минина, 24.
© Нижегородский государственный технический
университет им. Р.Е.Алексеева, 2009
Введение
Теплоемкостью тела называется величина, равная количеству теплоты, которое нужно сообщить телу, чтобы повысить его температуру на один Кельвин. Если при сообщении телу количества теплоты δQ температура тела повышается на dT, то, согласно определению, теплоемкость будет:
![]() (1)
(1)
Теплоемкостью одного моля вещества называется молярной теплоемкостью:
![]() (2)
(2)
Здесь υ – число молей, υ=m/M, где m – масса вещества, M – молярная масса вещества. В СИ единицей молярной теплоемкости является джоуль на моль-кельвин. Так: (Дж/моль·К).
Теплоемкость единицы массы вещества называется удельной теплоемкостью:
![]() (3)
(3)
В СИ единицей удельной теплоемкости является джоуль на килограмм-кельвин (Дж/(кг·К)).
Молярная и удельная теплоемкости связаны соотношением:
![]() (4)
(4)
Величина теплоемкости вещества зависит от условий, при которых происходит нагревание.
Помимо
внутренней энергии в термодинамике
широко пользуются и другими функциями
состояния термодинамической системы.
Особое место среди них занимает энтропия.
Пусть δQ
– элементарное количество теплоты,
сообщаемое нагревателем системе при
малом изменении её состояния, а
![]() -
температура нагревателя. Если процесс
обратимый, то температура системы тоже
равна
-
температура нагревателя. Если процесс
обратимый, то температура системы тоже
равна
![]() .
В отличие от δQ
отношение δQ/
.
В отличие от δQ
отношение δQ/![]() в обратимом процессе есть полный
дифференциал функции состояния системы,
называемой энтропией системы:
в обратимом процессе есть полный
дифференциал функции состояния системы,
называемой энтропией системы:
![]() (5)
(5)
Таким образом, в
обратимом процессе температура
![]() является интегрирующим делителем,
который обращает элементарную теплоту
δQ
в полный дифференциал dS.
является интегрирующим делителем,
который обращает элементарную теплоту
δQ
в полный дифференциал dS.
Чтобы вычислить
изменение энтропии системы, рассмотрим
обратимый процесс, приводящий систему
в состояние с одинаковой для обоих тел
температурой
![]() .
Этот процесс заключается в обратимой
передаче первым
.
Этот процесс заключается в обратимой
передаче первым
3
телом системы
какому-то внешнему телу такого количества
тепла, что температура первого тела
понижается до значения
![]() ,
и в обратимом
,
и в обратимом
получении вторым
телом извне такого количества тепла,
что его температура повышается до
значения
![]() .
Для того, чтобы быть обратимыми, оба эти
процесса должны протекать так, чтобы
температуры каждого из тел системы и
соответствующего внешнего тела были в
каждый момент времени одинаковы.
.
Для того, чтобы быть обратимыми, оба эти
процесса должны протекать так, чтобы
температуры каждого из тел системы и
соответствующего внешнего тела были в
каждый момент времени одинаковы.
![]()
Процесс охлаждения первого тела сопровождается уменьшением его энтропии:
![]() (6)
(6)
Процесс нагревания второго тела сопровождается увеличением его энтропии:
![]() (7)
(7)
Отметим что,
поскольку
![]() ,
,
![]() отрицательно, а
отрицательно, а
![]() положительно.
положительно.
Изменение энтропии системы складывается из изменений энтропии отдельных тел:
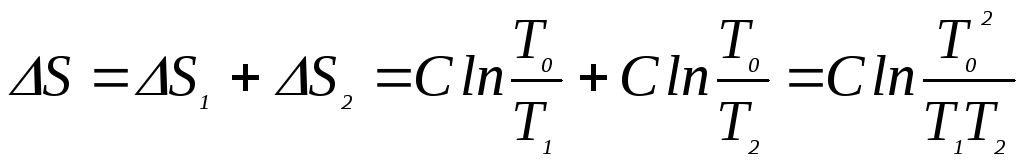 (8)
(8)
Подставив в (8)
значение (7) для
![]() ,
получим окончательное выражение энтропии
системы:
,
получим окончательное выражение энтропии
системы:
![]() (9)
(9)
Из (5) видно, что dS и δQ имеют один и тот же знак. Это позволяет по характеру изменения энтропии судить о направлении процесса теплообмена. При нагревании тела δQ>0 и его энтропия возрастает (dS>0), при охлаждении δQ<0 и энтропия тела убывает (dS<0). В обратимом адиабатном процессе δQ=TdS=0, так что dS=0 и S=const. Таким образом, обратимый адиабатный процесс представляет собой изоэнтропийный процесс.
4
Энтропия, подобно внутренней энергии, - аддитивная функция состояния системы: энтропия системы равна сумме энтропий всех тел, входящих в состав
системы. В курсе термодинамики доказывается, что энтропия изолированной системы в любом обратимом процессе не изменяется.
Это объясняется тем, что при передаче теплоты δQ от тела 1 к телу 2 в обратимом процессе температуры обоих тел одинаковы. Поэтому изменение dS2 энтропии тела 2, получающего теплоту δQ, равно и противоположно по знаку изменению dS1 энтропии тела 1, отдающего теплоту δQ:
![]() (10)
(10)
