
- •Нижний Новгород
- •Цель работы
- •Теоретический материал
- •Практическая часть
- •Обсуждение результатов Опыт 1 Пробирка №1
- •Пробирка №2
- •Опыт 2 Пробирка №1
- •Пробирка №2
- •Опыт 3 Пробирка №1
- •Вредные вещества, применяемые в работе
- •Литература
- •Цель работы
- •Теоретический материал.
- •Практическая часть Опыт 1.
- •Опыт 2(3б)
- •Вредные вещества,применяемые в работе.
- •Литература
- •Цель работы
- •Теоретический материал.
- •Способы выражения константы равновесия
- •Стандартная константа равновесия
- •Константа равновесия реакций в гетерогенных системах
- •Константа равновесия и изменение энергии Гиббса
- •Зависимость константы равновесия от температуры
- •Константа равновесия и константа скорости реакции
- •Методы расчета константы равновесия
- •Энтропийный расчёт изменения энергии Гиббса и константы равновесия реакции
- •Влияние температуры
- •Влияние давления
- •Влияние инертных газов
- •Влияние концентрации
- •Вредные вещества,применяемые в работе.
- •Литература
- •Массовая доля (также называют процентной концентрацией)
- •Объёмная доля
- •Молярность (молярная объёмная концентрация)
- •Нормальная концентрация (мольная концентрация эквивалента)
- •Мольная (молярная) доля
- •Моляльность (молярная весовая концентрация)
- •Титр раствора
- •Другие способы выражения концентрации растворов
- •Применимость способов выражения концентрации растворов, их свойства
- •Формулы перехода от одних выражений концентраций растворов к другим
- •Практическая часть Опыт 1
- •Опыт 2
- •Литература
- •«Электрохимические процессы»
- •Электролиз
- •Практическая часть
- •Вредные вещества, применяемые в работе
- •Литература
- •«Комплексные соединения»
- •Нижний Новгород
- •Цель работы
- •Теоретический материал
- •Массовая доля (также называют процентной концентрацией)
- •Объёмная доля
- •Молярность (молярная объёмная концентрация)
- •Нормальная концентрация (мольная концентрация эквивалента)
- •Мольная (молярная) доля
- •Моляльность (молярная весовая концентрация)
- •Эквивалентная масса
- •Обсуждение результатов Опыт 1
- •Опыт 2 Пробирка №1
- •Пробирка №2
- •Опыт 3 Пробирка №1
- •Вредные вещества, применяемые в работе
- •Литература
Электролиз
ЭЛЕКТРОЛИЗ
ОБЩИЕ ПОНЯТИЯ
Электролизом называют процессы, происходящие на электродах в растворах и расплавах электролитов под действием постоянного электрического тока, подаваемого от внешнего источника тока.
При электролизе происходит превращение электрической энергии в химическую. Для этого процесса G > 0, при стандартных условиях он самопроизвольно не идет.
Ячейка для электролиза, называемая электролизером (рис. 8.13), состоит из двух электродов и электролита.
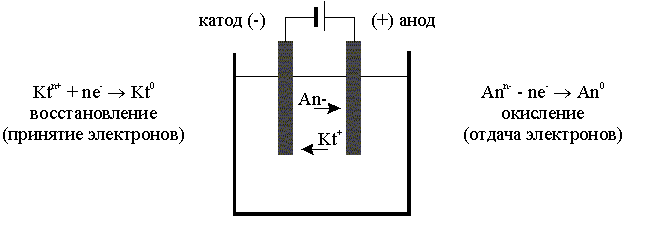
Рис. 8.13. Схема, иллюстрирующая принцип действия электролизера.
Электрод, на котором идет реакция восстановления (катод), у электролизера подключен к отрицательному полюсу внешнего источника тока. Электрод, на котором протекает реакция окисления (анод), подключен к положительному полюсу источника тока. Положительно заряженные ионы - катионы - перемещаются к отрицательному электроду - катоду, а отрицательно заряженные ионы - анионы - перемещаются к положительному электроду - аноду.
Таким образом, сущность процесса электролиза заключается в том, что на катоде происходит процесс восстановления, а на аноде - процесс окисления.
Для практического осуществления электролиза конкретного электролита необходимо определенное минимальное пороговое напряжение. Это напряжение называется напряжением разложения электролита Uн.р. Повышение напряжения, необходимое для развития процесса электролиза, обусловленное поляризацией электродов и омическими потерями, называется перенапряжением.
U = (А - К) + поляриз. + I· R
При наличии перенапряжения потенциал катода становится более отрицательным, а потенциал анода - более положительным
Увеличение напряжения по сравнению с э.д.с. приводит к перерасходу электрической энергии. Иногда поляризация при электролизе играет положительную роль.
ЭЛЕКТРОЛИЗ РАСПЛАВОВ ЭЛЕКТРОЛИТОВ
Рассмотрим электродные реакции на примере электролиза расплава хлорида натрия.
Под действием температуры ионная кристаллическая решетка NaCl разрушается на ионы Na+ и Cl-. Если погрузить в расплавленную соль два графитовых (инертных) электрода и подключить их к полюсам внешнего источника тока, то в электролите начнется направленное движение ионов и на электродах будут происходить следующие реакции:
а) восстановление ионов Na+ до металлического натрия (катодный процесс).
б) окисление ионов Cl- до газообразного хлора (анодный процесс).
Суммируя уравнения катодного и анодного процессов, (с учетом электронного баланса) получим окислительно-восстановительную реакцию, протекающую при электролизе:
2NaCl = 2Na(ж) + Cl2(г)
ЭЛЕКТРОЛИЗ РАСТВОРОВ ЭЛЕКТРОЛИТОВ
При электролизе растворов электролитов происходит конкуренция между растворенным веществом и растворителем за участие в электродных процессах. Например, в водных растворах солей кроме анионов и катионов соли всегда имеются молекулы H2O и ионы H+ и OH-. При наличии нескольких видов ионов или недиссоциированных молекул электрохимически активных веществ возможно протекание нескольких электродных реакций.
Для объяснения электродных процессов, происходящих при электролизе разбавленных водных растворов электролитов, можно руководствоваться следующими правилами:
На катоде в первую очередь восстанавливаются (принимают электроны) катионы с наиболее высокими (максимальными) значениями электродного потенциала (сильные окислители).
1. Если электродный потенциал катиона Me/Men+ < -1,6 В, то на катоде восстанавливаются ионы H+ молекулы H2O с выделением H2 и накоплением в растворе OH-:
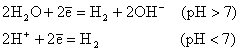
2. При
значении стандартного электродного
потенциала катиона ![]() на
катоде восстанавливаются только ионы
металла, а разряд ионов H+ не
происходит:
на
катоде восстанавливаются только ионы
металла, а разряд ионов H+ не
происходит:
![]()
3. Если -1,6 В <Me/Men+ < 0 В, то на катоде протекают два процесса: восстановление ионов Н+ и ионов металла. Это обусловлено тем, что, во-первых, потенциал водородного электрода зависит от рН раствора:
H2/2H+ = -0,059· pH,
во-вторых, выделение водорода на катоде происходит с более высоким перенапряжением по сравнению с перенапряжением разряда многих металлов.
Высокое водородное перенапряжение - явление положительное, благодаря этому, из водных растворов удается выделять на катоде марганец, цинк, хром, железо, кадмий, кобальт, никель и другие металлы. Все вышесказанное можно представить следующей схемой:
На аноде, в первую очередь, окисляются (отдают электроны) анионы с минимальным значением электродного потенциала (сильные восстановители).
ЭЛЕКТРОЛИЗ С РАСТВОРИМЫМИ АНОДАМИ
До сих пор были рассмотрены случаи электролиза с нерастворимыми (пассивными) электродами, когда материалы электродов не претерпевали никаких изменений. Важными являются случаи электролиза с растворимыми анодами. Само название анодов говорит о том, что такие электроды под действием внешнего напряжения растворяются, т.е. в процессе окисления участвуют материалы анодов. К растворимым относятся медные, оловянные, серебряные, никелевые, цинковые, кобальтовые, кадмиевые аноды ( Me/Men+ < +1,23 В).
При электролизе водных растворов на растворимом аноде возможно протекание следующих процессов:
окисление анода;
окисление анионов раствора;
окисление молекул воды.
В первую очередь на аноде пойдет процесс с наименьшей величиной электродного потенциала. Например, при электролизе водного раствора CuSO4 с медным анодом:
CuSO4 Cu2+ + SO42- (рН = 7)
На аноде:
|
(+) А |
SO42- |
2SO42-/S2O82-= +2,01 В |
|
|
H2O (OH-) |
OH-/O2= +0,82 В |
|
|
Cu |
Cu/Cu2+= +0,337 В |
Наименьшее значение электродного потенциала - для меди. Поэтому на аноде окисляется медь (т.е. материал анода):
![]()
Катионы меди из металлической решетки переходят в раствор.
На катоде:
|
(-) K |
Cu2+ |
Cu/Cu2+= +0,337 В |
|
|
H2O (H+) |
H2/2H+= -0,41 В |
Восстанавливаются ионы меди:
![]()
Таким образом, сущность этого процесса сводится к переносу ионов металла с анода на катод.
Cu2+ + Cu = Cu + Cu2+
Как видим, в случае растворимых анодов никаких принципиальных отличий от случаев электролиза с нерастворимыми анодами нет, и процессы, протекающие на электродах, подчиняются тем же закономерностям.
