
- •Нижний Новгород
- •Цель работы
- •Теоретический материал
- •Практическая часть
- •Обсуждение результатов Опыт 1 Пробирка №1
- •Пробирка №2
- •Опыт 2 Пробирка №1
- •Пробирка №2
- •Опыт 3 Пробирка №1
- •Вредные вещества, применяемые в работе
- •Литература
- •Цель работы
- •Теоретический материал.
- •Практическая часть Опыт 1.
- •Опыт 2(3б)
- •Вредные вещества,применяемые в работе.
- •Литература
- •Цель работы
- •Теоретический материал.
- •Способы выражения константы равновесия
- •Стандартная константа равновесия
- •Константа равновесия реакций в гетерогенных системах
- •Константа равновесия и изменение энергии Гиббса
- •Зависимость константы равновесия от температуры
- •Константа равновесия и константа скорости реакции
- •Методы расчета константы равновесия
- •Энтропийный расчёт изменения энергии Гиббса и константы равновесия реакции
- •Влияние температуры
- •Влияние давления
- •Влияние инертных газов
- •Влияние концентрации
- •Вредные вещества,применяемые в работе.
- •Литература
- •Массовая доля (также называют процентной концентрацией)
- •Объёмная доля
- •Молярность (молярная объёмная концентрация)
- •Нормальная концентрация (мольная концентрация эквивалента)
- •Мольная (молярная) доля
- •Моляльность (молярная весовая концентрация)
- •Титр раствора
- •Другие способы выражения концентрации растворов
- •Применимость способов выражения концентрации растворов, их свойства
- •Формулы перехода от одних выражений концентраций растворов к другим
- •Практическая часть Опыт 1
- •Опыт 2
- •Литература
- •«Электрохимические процессы»
- •Электролиз
- •Практическая часть
- •Вредные вещества, применяемые в работе
- •Литература
- •«Комплексные соединения»
- •Нижний Новгород
- •Цель работы
- •Теоретический материал
- •Массовая доля (также называют процентной концентрацией)
- •Объёмная доля
- •Молярность (молярная объёмная концентрация)
- •Нормальная концентрация (мольная концентрация эквивалента)
- •Мольная (молярная) доля
- •Моляльность (молярная весовая концентрация)
- •Эквивалентная масса
- •Обсуждение результатов Опыт 1
- •Опыт 2 Пробирка №1
- •Пробирка №2
- •Опыт 3 Пробирка №1
- •Вредные вещества, применяемые в работе
- •Литература
Практическая часть Опыт 1
В три пробирки наливаем по 2мл в первую-дистиллированной воды,во вторую- 0.1 н. раствора соляной кислоты,в третью-0.1н. раствора гидроксида натрия.Прибавляем в каждую пробирку по 1-2 капли раствора фенолфталеина.Аналогичный опыт проводим с метилоранжом и лакмусом.Заносим результаты в таблицу.
|
Индикатор |
Кислая среда
pH=1 |
Щелочная среда
pH=13 |
Нейтральная среда pH=7 |
|
Фенолфталеин |
прозрачный |
малиновый |
прозрачный |
|
Метилоранж |
прозрачный |
желтый |
оранжевый |
|
Лакмус |
бордовый |
синий |
фиолетовый |
При проведении данного опыта наблюдаем изменение окраски в различные цвета.
Опыт 2
Пробирка №1
В пробирку нальем с 0.1М раствор уксусной кислоты.Добавим 2 капли метилоранжа.
Наблюдаем окраску раствора в сетло-красный цвет.
Пробирка №2
В пробирку нальем с 0.1М раствор уксусной кислоты.Добавим 2 капли метилоранжа.
Наблюдаем окраску раствора в сетло-красный цвет.Добавляем несколько кристалликов ацетата натрия.Наблюдаем изменение окраски из светло-красного в оранжевый.
Опыт 3
Пробирка №1
В пробирку нальем с 0.1М раствор аммиака.Добавим 2 капли фенолфталеина.
Наблюдаем окраску раствора в ярко-розовый цвет
Пробирка №2
В пробирку нальем с 0.1М раствор аммиака.Добавим 2 капли фенолфталеина.
Наблюдаем окраску раствора в ярко-розовый цвет.Добавляем хлорид амония.Наблюдаем изменение окраски из ярко-розового в бледно-розовый.
Опыт 4
Пробирка №1
Смешаем в пробирке 2 мл насыщенного раствора хлорида стронция и 2мл насыщенного раствора сульфата кальция.Наблюдаем помутнение раствора и выпадение осадка.
Пробирка №2
Смешаем в пробирке 2 мл насыщенного раствора хлорида кальция и 2 мл насыщенного раствора сульфата странция.Наблюдаем обесцвечивание раствора.
Опыт 6
Пробирка №1
Нальем в пробирку 3мл дистиллированной воды.В пробирку добавляем пару капель лакмуса и несколько кристалликов хлорида натрия.Наблюдаем изменение окраски в фиолетовый цвет.
Пробирка №2
Нальем в пробирку 3мл дистиллированной воды.В пробирку нальем пару капель лакмуса и несколько кристалликов хлорида алюминия.Наблюдаем изменение окраски в бледно-розовый цвет.
Пробирка №3
Нальем в пробирку 3мл дистиллированной воды.В пробирку нальем пару капель фенолфталлеина и несколько кристалликов карбоната калия. Наблюдаем изменение окраски в ярко-розовый цвет.
Обсуждение результатов
Опыт 1
Считая,что диссоциация электролита полная(α=1),получаем рН 0.1 н раствора HCl;
н раствора NaOH.
1)Определяем рН 0.1 н раствора NaOH
0.1 н =mHCL/ЭНСl= mHCL/36.5 г/моль
mHCL=3.65 г в 1 л раствора
СHCl=mHCL/(MHCl*1л)=0.1 моль/л
Так как α=1,то [H+]=CHCl
[H+]=10-1 моль/л
pH=-lg10-1=1
2)Определяем рН 0.1 н раствора NaOH
0.1н=mNaOH/ЭNaOH
mNaOH=0.1н*40г/моль=4 г в 1л раствора
СNaOH=mNaOH/(MNaOH*1л)=0.1 моль/л
Так как α=1,то [OH-]=CNaOH
Тогда [H+]=KH2O/[OH-]=10-14/10-1=10-13
pH=-lg10-13=13
Опыт 2
После того,как добавили в уксусную кислоту метилоранж,раствор становится светло-красного цвета,т.к среда кислая.
CH3COOH=CH3COO-+H+
K=([ CH3COOH]*[ H+ ])/[CH3COOH]
После добавления во вторую пробирку ацетата натрия раствор преобретает оранжевую окраску
Концентрация ионов водорода понижается,следственно среда становится нейтральной.
Для того,чтобы равновесие сместилось в сторону образования недиссоциированных малекул,нужно добавиться в раствор слабой кислоты ионы кислотного остатка,образовавших килсоту.
Опыт 3
После того,Как мы добавляем к раствору аммиака фенолфталеин,раствор приобретает розовую окраску.
NH4OH=[NH4+]+[OH-]
K=([NH4+]*[OH-])/[ NH4OH]
Добавляем во вторую пробирку хлорид аммония.Видидим побледнее раствора.
Концентрация ионов увеличивается,следственно среда становится нейтральной.
Для того,чтобы равновесие сместилось в сторону образования недиссоциированных малекул,нужно в раствор слабого основания ввести ионы металла,который образует основание.
1)Определим pH 0.1M раствора аммиака(К=1,79*10-5)
CNH4OH=0.1 моль/л
α
=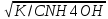 =0,01338
=0,01338
[OH-]=0.1моль/л* α=0.001338
[H+]=10-14/[OH-]=7,47435*10-13
pH=-lg7,47435*10-13=12
2)Определяем как изменится рН раствора при добавлении к 1л 0.1М р-ра аммиака 0.1моль/ хлорида аммония.
CNH4OH=0.1 моль/л
K=([NH4+]*[OH-])/[NH4OH]
[OH-]=1,79*10-5
[H+]=10-14/1,79*10-5=5,587*10-10
pH=-lg[H+]=-lg 5,587*10-10=9
Опыт 4
После того,как мы смешали раствор хлорида стронция и сульфата кальция наблюдается выпадение осадка
Это происходит из-за:
SrCl2+CuSO4→SuSO4+CuCl2
[Sr2+]*[SO4] > ПР
ПPSrSO4=3,2*10-7
При смешивании растворов хлорида кальция и сульфата стронция выпадения осадка не наблюдается
CaCl2+SrSO4→CaSO4+SrCL2
Опыт 6
Пробирка №1
При добавлении к воде лакмуса и хлорида натрия,цвет раствора остается первоночальным-фиолетовым.Хлорид натрия-соль сильной кислоты и сильного основания.Следственно, данная соль не подвергается гидролизу.
Среда 1:нейтральная.
Среда 2:нейтральная.
Пробирка №2
При добавлении к воде лакмуса и хлорида алюминия,цвет раствора изменяется с фиолетового на бледно-розовый.Это свидетельствует о том,что среда стала кислой.То есть она подвергается гидролизу.
Среда 1:нейтральная.
Среда 2:кислая.
Пробирка №3
При добавлении к воде фенолфталеина и карбоната калия ,цвет раствора изменяется с фиолетового на ярко-розовый(малиновый).Это свидельствует о том,что среда стала щелочной.То есть данная соль подвергается гидролизу.
Среда 1:нейтральная
Среда 2:щелочная.
Выводы:
Изучив теорию ,нам удалось выяснить,соли могут подвергаться и не подвергаться гидролизу.Мы провели опыты по окраски индикаторов в различных средах.Наблюдали смещение равновесия в слабой кислоте и в слабом основании.Удалось исследовать условия выпадения осадка.
Вредные вещества, применяемые в работе
|
№ |
Вещество |
Действия на организм |
Профилактика | |
|
1 |
HCL |
При высоких концентрациях - раздражение слизистых, в особенности носа; конъюнктивит; помутнение роговицы. Охриплость, чувство удушья, покалывание в груди, насморк, кашель, иногда кровь в мокроте. |
1)Ингаляция кислорода.
2)Промывание глаз, носа, полоскание 2% раствором соды. | |
|
2 |
KOH |
Действует на кожу и слизистые оболочки прижигающим образом. Особенно опасно попадание даже малейших частиц гидроксида калия вглаза, поэтому все работы с этим веществом должны проводиться в резиновых перчатках и очках. Гидроксид калия разрушает бумагу, кожу и др. материалы органического происхождения. |
При контакте слизистых поверхностей с едкой щёлочью необходимо промыть поражённый участок струей воды, а при попадании на кожу слабым раствором уксусной кислоты.
| |
|
3 |
CH3COOH |
Пары уксусной кислоты раздражают слизистые оболочки верхних дыхательных путей. Концентрированная уксусная кислота способна вызывать химические ожоги, инициирующие развитие коагуляционных некрозов прилегающих тканей различной протяженности и глубины. |
При попадании на кожу образуется краснота и боли, затем грязновато-белые язвы. Первая помощь при ожоге: обильное обмывание водой. Индивидуальные средства защиты: противогаз марки "В", респиратор, резиновые перчатки, сапоги, фартук. | |
|
4 |
NaOH |
Может вызвать химические ожоги |
Промыть прожженное место водой,обработать слабым раствором уксусной кислоты. | |
|
5 |
(NH4)OH |
Раздрожимоть дыхательных путей. |
Обесцвечивать пострадавшему свежий воздух. | |
