
- •4. Растворы и реакции в растворах
- •4.2. Термодинамическое описание молекулярного раствора
- •4.3. Растворы электролитов
- •4.4. Электролитическая диссоциация
- •4.5. Ионные реакции и равновесия в растворах рассматриваются на основе:
- •4.6. Ионизация воды. PH и pOh
- •4.7. Влияние общих ионов
- •4.8. Буферные растворы.
- •4.9. Кислоты и основания
- •4.10. Нейтрализация и гидролиз
- •4.11. Амфотерные электролиты
- •4.12. Слабо растворимые соли
- •4.13. Факторы, обусловливающие более полную завершенность реакций.
4.11. Амфотерные электролиты
Наряду с кислотными и основными гидроксидами есть и такие, которые в водных растворах диссоциируют по двум направлениям:
R+ + OH− ← ROH → RO− +H+
Такие двойственные гидроксиды называются амфотерными. С кислотами они реагируют как основания, а с основными - как кислоты. К ним относят: Zn(OH)2, Al(OH)3, Ga(OH)3, Cr(OH)3, Sn(OH)2, Pb(OH)2, Sb(OH)3 и др.
По практически равным константам диссоциации в кислотную и основную стороны идеальной амфотерностью обладает Ga(OH)3 ≡ H3GaO3.
Пример реакций амфотерного гидроксида Sn(OH)2:
Sn(OH)2 + H2SO4 = SnSO4 + H2O
Sn(OH)2 + 2 KOH = K2[Sn(OH)4]
Однозначный фактор, определяющий протекание записанной реакции - значение ΔrG°
HCN + CH3(CO)Oˉ← CH3(CO)OH + CNˉ , ΔrG° = 43 кДж/моль.
(4,9·10-10) (1,8·10-5)
Положительное значение ΔrG° подтверждает наблюдаемый факт, что равновесие в данной реакции смещено в сторону образования менее диссоциированного электролита (в скобках под соответствующими кислотами приведены значения их констант диссоциации).
4.12. Слабо растворимые соли
В насыщенных растворах устанавливается равновесие между раствором и не растворившимся осадком
KkAа
= k
K+
+ а
A−,
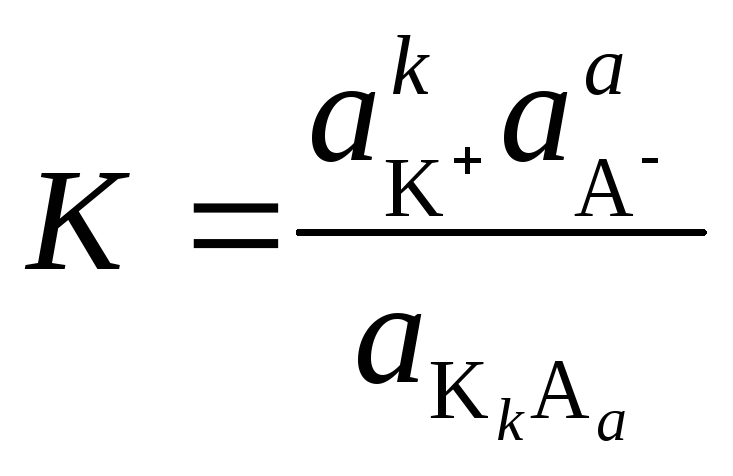
Объединение
постоянной для индивидуальной твердой
фазы активности
![]() вместе с константой гетерогенного
равновесия K
носит название произведения
растворимости
ПР.
вместе с константой гетерогенного
равновесия K
носит название произведения
растворимости
ПР.
![]() ·
K
≡ ПР
=
·
K
≡ ПР
=
![]()
В разбавленных растворах активности можно заменить концентрациями:
ПР = [K+]k ∙[A−]a.
Для сульфида свинца растворимость s = [S2-] = [Pb2+] определяется концентрацией ионов S2- или Pb2+
ПРPbS
=
[Pb2+]
[S2-]
= s2,
s
=![]() =
10-14
моль/л.
=
10-14
моль/л.
Расчет растворимости сульфида висмута по значению ПР:
![]() =
[Bi3+]2
[S2-]3
= (2s)2·
(3s)3
= 108 s5
s
= (ПР/108)1/5.
=
[Bi3+]2
[S2-]3
= (2s)2·
(3s)3
= 108 s5
s
= (ПР/108)1/5.
ПР как производное ТЗДМ применимо к ионам в составе сложных смесей. При большом избытке ионов одного вида равновесное значение другого в растворе уменьшается, а потому он переходит в осадок.
Попытаемся
растворить CaSO4
в 1М растворе Na2SO4.
Растворимость индивидуального CaSO4,
совпадающая с содержанием ионов Ca2+:
![]() =
1,8·10-2 М.
Добавление небольшого количества CaSO4,
практически не меняющего концентрацию
ионов SO42-
в 1М растворе Na2SO4,
приводит к тому, что добавляемая порция
ионов Ca2+
не может превысить: [Ca2+]
= ПР(CaSO4)
/ [SO42-]
= 3,2 · 10-4 /
1 = 3,2 · 10-4.
Растворимость оказалась подавленной
в 56 раз. На практике H2S
используют для высаживания сульфидов
металлов; HCl
используют для очистки NaCl
при выделении его из раствора и т.д.
=
1,8·10-2 М.
Добавление небольшого количества CaSO4,
практически не меняющего концентрацию
ионов SO42-
в 1М растворе Na2SO4,
приводит к тому, что добавляемая порция
ионов Ca2+
не может превысить: [Ca2+]
= ПР(CaSO4)
/ [SO42-]
= 3,2 · 10-4 /
1 = 3,2 · 10-4.
Растворимость оказалась подавленной
в 56 раз. На практике H2S
используют для высаживания сульфидов
металлов; HCl
используют для очистки NaCl
при выделении его из раствора и т.д.
4.13. Факторы, обусловливающие более полную завершенность реакций.
Количественные закономерности, определяемые ТЗДМ и качественно охарактеризованные Ле-Шателье и Брауном, показывают, что реакция может быть смещена в сторону образования продуктов путем удаления одного или нескольких продуктов из реакционной смеси.
1) Реакции, протекающие с образованием газов
CaCO3 (тв) + 2H+ = Ca2+ + H2CO3 (H2O + CO2).
2) Реакции с образованием осадков
Fe3+ + 3OH− = Fe(OH)3 (тв),
Pb2+ + CrO42- = PbCrO4 (тв).
3) Реакции с образованием слабо диссоциирующих веществ (слабых электролитов)
Cu2+ + 4NH3 = Cu(NH3)42+.
Подобные реакции широко применяются для аналитических целей и в промышленности.
