
- •4. Растворы и реакции в растворах
- •4.2. Термодинамическое описание молекулярного раствора
- •4.3. Растворы электролитов
- •4.4. Электролитическая диссоциация
- •4.5. Ионные реакции и равновесия в растворах рассматриваются на основе:
- •4.6. Ионизация воды. PH и pOh
- •4.7. Влияние общих ионов
- •4.8. Буферные растворы.
- •4.9. Кислоты и основания
- •4.10. Нейтрализация и гидролиз
- •4.11. Амфотерные электролиты
- •4.12. Слабо растворимые соли
- •4.13. Факторы, обусловливающие более полную завершенность реакций.
4.3. Растворы электролитов
Значительное число гетерополярных химических соединений под действием полярных растворителей, среди которых наиболее характерным является вода, испытывают кардинальную структурно-энергетическую перестройку при растворении. Поляризующее взаимодействие растворителя приводит к диссоциации растворенного вещества на сольватированные заряженные фрагменты, которые называют ионами. В физике такие образования называют квазичастицами с эффективными массами и размерами, иногда значительно отличающимися от исходных «голых» частиц. Их принципиальная роль в описании конденсированных фаз заключается в том, что они включают в себя значительную часть энергетики их образования. Это упрощает описание, сводя систему преобразованных частиц-ионов к почти идеальной системе, с достаточно слабым межионным взаимодействием.
При таком подходе выделяется роль растворителя, который, сыграв активную роль в образовании ионов, превращается в фоновую среду.
Сильные
электролиты −
![]() при растворении практически полностью
диссоциируют наν+
число положительных (
при растворении практически полностью
диссоциируют наν+
число положительных (![]() )
иν−
число
отрицательных (
)
иν−
число
отрицательных (![]() )
ионов согласно уравнениюреакции
диссоциации (ионизации):
)
ионов согласно уравнениюреакции
диссоциации (ионизации):
![]() (заряды
ионов z+
> 0, z−
< 0) . (4.4)
(заряды
ионов z+
> 0, z−
< 0) . (4.4)
Пример: CaCl2 → Ca2+ + 2Cl ¯ (z+ = 2, z− = -1 ).
Если m – моляльность растворенного вещества (электролита), то моляльности положительных и отрицательных ионов: m+ = ν+m , m− = ν− m.
Применим льюисовское определение химического потенциала компонента к неидеальной системе ν = ν++ ν− взаимодействующих ионов
![]() ,
,
где
коэффициенты активности γ+
и γ−
соответствуют
моляльностям. Ввиду невозможности их
отдельного определения используется
среднеионный коэффициент активности:
![]() , (4.5)
, (4.5)
а химический потенциал электролита приобретает вид:
![]() , (4.6)
, (4.6)
Физически
обоснованный результат статистической
теории Дебая-Хюккеля для разбавленных
растворов (без вывода) известен под
названием предельного
закона.
![]() , (4.7)
, (4.7)
где
![]() - ионная
сила;
- ионная
сила;
![]()
- коэффициент Aγ(Т) кроме физических постоянных (числа Авогадро и постоянной Больцмана) включает в себя: ε – относительную диэлектрическую проницаемость (78,54 (H2O)); ρ – плотность раствора, г/см3 (для разбавленного раствора при 25о С ρH2O = 0,997 г/см3).
Значения Aγ для ряда растворителей при 25oC равны: 0,51 (H2O); 1,778 (СH3OH); 3,7613 (ацетон).
Несмотря на ограниченную концентрационную область применимости (≤ 0,01М) теория Дебая-Хюккеля имеет большое теоретическое значение, поскольку эмпирически установленная зависимость lg γ± от I1/2 получила обоснование с позиции статистической физики.
Выводы:
γ± → 1 при m → 0, т.е. при значительном разбавлении γ± можно считать равным 1, а раствор становится идеальным.
Стандартные энтальпии и энтропии образования ионов содержатся в
 и составляют важнейшую справочную
информацию.
и составляют важнейшую справочную
информацию.
4.4. Электролитическая диссоциация
Анализ
молекулярно-ионных систем с частичной
или произвольной степенью
(долей)
диссоциации α
производится на основе ТЗДМ для реакции
диссоциации ![]() (4.4′)
(4.4′)
Стехиометрическое произведение концентраций для неидеальных систем должно быть выражено через льюисовские активности компонентов. ТЗДМ для реакции диссоциации называют уравнением диссоциации (ионизации) электролита:
![]() .
(4.8)
.
(4.8)
Подставляя равновесные концентрации, выраженные через степень диссоциации α, получим
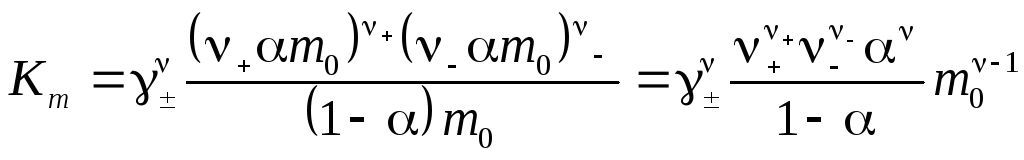 .
(4.8')
.
(4.8')
Для 1,1-валентных электролитов (ν+ = ν− = 1, ν = 2)
![]() (4.8'')
(4.8'')
Решение квадратного уравнения (4.8''), определяющее степень диссоциации
![]() при
m0
→ 0
и Km
→ ∞
(4.9)
при
m0
→ 0
и Km
→ ∞
(4.9)
во взаимосвязи с константой диссоциации Km называют законом разведения Оствальда
Простейший анализ решения показывает:
Чем больше константа диссоциации, тем больше степень диссоциации.
Даже для слабых электролитов (с малой Km < 1) можно повысить степень их диссоциации путем разбавления (m0 → 0).
Для очень слабых электролитов, диссоциирующих с образованием того же иона как у растворителя, полной диссоциации электролита не происходит. Такие системы следует анализировать с позиции молекулярных моделей растворов.
