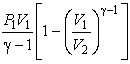Адиабатический процесс работа ид газа
.doc
Адиабатический
процесс - это такое изменение состояний
газа, при котором он не отдает и не
поглощает извне теплоты. Следовательно,
адиабатический процесс характеризуется
отсутствием теплообмена газа с окружающей
средой. Адиабатическими можно считать
быстро протекающие процессы. Так как
передачи теплоты при адиабатическом
процессе не происходит, то ![]() и
уравнение I начала термодинамики
принимает вид
и
уравнение I начала термодинамики
принимает вид
|
|
(9.20) |
или
![]()
т.е. внешняя работа газа может производиться вследствие изменения его внутренней энергии. Адиабатное расширение газа (dV>0) сопровождается положительной внешней работой, но при этом внутренняя энергия уменьшается и газ охлаждается (dT<0).
Сжатие газа (dV0, т.е. адиабатное сжатие газа сопровождается его нагреванием.
Найдем связь между параметрами состояния идеального газа (например, Р и V) в адиабатическом процессе. Для этого перепишем (9.20) в форме
![]()
а
величину ![]() найдем
из уравнения Менделеева - Клапейрона
найдем
из уравнения Менделеева - Клапейрона
![]() Таким
образом,
Таким
образом,
![]() или,
учитывая, что для идеального
газа
или,
учитывая, что для идеального
газа ![]()
![]() Разделим
обе части этого уравнения на
Разделим
обе части этого уравнения на ![]()
![]()
где ![]() безразмерная
величина, называемая постоянной адиабаты.
Пренебрегая зависимостью
безразмерная
величина, называемая постоянной адиабаты.
Пренебрегая зависимостью![]() от
температуры, можно считать, что для
данного газа
от
температуры, можно считать, что для
данного газа ![]() .
Интегрируя последнее уравнение
.
Интегрируя последнее уравнение
![]() получим
получим
![]() т.е.
т.е.
|
|
(9.21) |
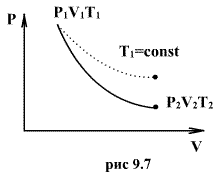
Это выражение называют уравнением Пуассона. Соотношение между давлением и температурой, а также между объемом и температурой идеального газа в адиабатическом процессе имеют вид
![]()
Эти
соотношения легко получить из (9.21),
пользуясь уравнением Менделеева -
Клапейрона. Линию, изображающую
адиабатический процесс в диаграмме
состояния, называют адиабатой. На рис.
9.7 сплошной линией показан вид адиабаты
в (P-V) диаграмме. Для сравнения в том же
рисунке пунктирной линией изображена
изотерма, соответствующая температуре
газа в начальном состоянии 1. Так как
для любого идеального газа показатель
адиабаты ![]() ,
то в (P-V) диаграмме адиабата всегда идет
круче, чем изотерма. Объясняется это
тем, что при адиабатическом сжатии
увеличение давления обусловлено не
только уменьшением объема газа, как при
изотермическом сжатии, то также еще и
увеличения температуры. При адиабатическом
расширении температура газа уменьшается,
поэтому давление газа падает быстрее,
чем при изотермическом расширении.
,
то в (P-V) диаграмме адиабата всегда идет
круче, чем изотерма. Объясняется это
тем, что при адиабатическом сжатии
увеличение давления обусловлено не
только уменьшением объема газа, как при
изотермическом сжатии, то также еще и
увеличения температуры. При адиабатическом
расширении температура газа уменьшается,
поэтому давление газа падает быстрее,
чем при изотермическом расширении.
Работу, совершаемую газом в адиабатическом процессе, найдем интегрируя выражение
![]() Полная
работа
Полная
работа
![]()
Из
уравнения Майера (9.18) и выражения ![]() для
показателя адиабаты γ следует, что
для
показателя адиабаты γ следует, что
![]()
Поэтому
|
|
(9.22) |
В
соответствии с соотношением ![]()
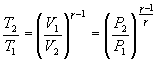
Следовательно, выражение (9.22) для работы можно представить в виде
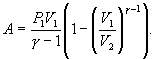 или
или
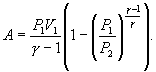
.6. Политропический процесс
В параграфе 2.4 отмечалось, что важным классом термодинамических процессов являются процессы, происходящие при постоянной теплоемкости, то есть политропические процессы. К таким процессам, в частности, относятся адиабатический, изотермический, изобарический и изохорический процессы.
Для
идеального газа нетрудно получить
уравнение политропического процесса
тем же способом, которым ранее было
выведено уравнение Пуассона. Пусть
молярная теплоёмкость идеального газа
в политропическом процессе равна ![]() .
Тогда в соответствии с первым началом
термодинамики (1.5) имеем
выражение:
.
Тогда в соответствии с первым началом
термодинамики (1.5) имеем
выражение:
|
|
(2.99) |
из которого следует:
|
|
(2.100) |
Подставляя это выражение в формулу (2.76) получим
|
|
(2.101) |
или с учетом соотношения Майера (2.70)
|
|
(2.102) |
Сравнение
формул (2.100) и (2.102) при
условии, что ![]() ,
позволяет записать уравнение
,
позволяет записать уравнение
|
|
(2.103) |
аналогичное уравнению (2.79). Здесь введен параметр
|
|
(2.104) |
который называется показателем политропы.
Из
этой формулы можно также получить
зависимость молярной теплоемкости ![]() от
показателя политропы
от
показателя политропы ![]() :
:
|
|
(2.105) |
Преобразование формулы (2.103) к виду:
|
|
(2.106) |
и интегрирование полученного уравнения дает
|
|
(2.107) |
Уравнение (2.107) называется уравнением
политропического процесса или политропы –
кривой, описываемой таким уравнением
в переменных ![]() и
и ![]() .
.
Аналогично уравнениям адиабаты (2.86) и (2.87) уравнение политропы может быть переписано в других термодинамических координатах:
|
|
(2.108) |
|
|
(2.109) |
При
адиабатическом процессе ![]() ,
что соответствует нулевой теплоемкости.
Подставив
,
что соответствует нулевой теплоемкости.
Подставив ![]() в
формулу (2.104) и
сравнив получившееся выражение с (2.80),
имеем
в
формулу (2.104) и
сравнив получившееся выражение с (2.80),
имеем ![]() ,
и уравнение политропы (2.107) становится
уравнением адиабаты:
,
и уравнение политропы (2.107) становится
уравнением адиабаты: ![]() .
.
Если
процесс изотермический, то ![]() ,
так как при этом
,
так как при этом ![]() .
В этом случае показатель политропы
.
В этом случае показатель политропы ![]() в
пределе равен единице, и уравнение
политропы (2.107) преобразуется
в уравнение Бойля-Мариотта (2.11):
в
пределе равен единице, и уравнение
политропы (2.107) преобразуется
в уравнение Бойля-Мариотта (2.11): ![]() .
Обратим внимание на то, что поскольку
при выводе уравнения политропы мы
исключали величину
.
Обратим внимание на то, что поскольку
при выводе уравнения политропы мы
исключали величину ![]() ,
то этот вывод не может считаться полностью
корректным для изотермического процесса.
,
то этот вывод не может считаться полностью
корректным для изотермического процесса.
Для
изобарического процесса при ![]() показатель
политропы
показатель
политропы ![]() ,
и уравнение (2.107) принимает
форму:
,
и уравнение (2.107) принимает
форму: ![]() .
.
При
изохорическом процессе ![]() должно
стать равным
должно
стать равным ![]() ,
что соответствует случаю, когда
показатель
,
что соответствует случаю, когда
показатель ![]() .
Очевидно, переход в формуле (2.107) к
указанному пределу некорректен. Это
связано с тем, что при выводе уравнения
политропы предполагалось, что
.
Очевидно, переход в формуле (2.107) к
указанному пределу некорректен. Это
связано с тем, что при выводе уравнения
политропы предполагалось, что ![]() (см.
переход к формуле (2.103)).
(см.
переход к формуле (2.103)).
Если
умножить уравнение (2.100) на
величину ![]() и
сложить его с уравнением (2.102),
предварительно умноженным на величину
и
сложить его с уравнением (2.102),
предварительно умноженным на величину ![]() ,
то получим уравнение политропы в
дифференциальном виде
,
то получим уравнение политропы в
дифференциальном виде
|
|
(2.110) |
При ![]() это
уравнение приобретает форме:
это
уравнение приобретает форме:
|
|
(2.111) |
Отсюда
имеем ![]() или
или ![]() .
Из уравнения (2.110) также
следует, что в процессе, при котором
.
Из уравнения (2.110) также
следует, что в процессе, при котором ![]() ,
давление постоянно:
,
давление постоянно: ![]() .
.
Для
политропических процессов значение
теплоёмкости и, соответственно, показателя
политропы могут принимать любые величины.
Отрицательные значения теплоёмкости,
когда показатель политропы ![]() принимает
значения от единицы до величины g (см.
формулу (2.105)),
соответствуют таким условиям, при
которых внутренняя энергия термодинамической
системы убывает при передаче ей
положительного количества теплоты. Это
может быть осуществлено при принудительном
расширении газа.
принимает
значения от единицы до величины g (см.
формулу (2.105)),
соответствуют таким условиям, при
которых внутренняя энергия термодинамической
системы убывает при передаче ей
положительного количества теплоты. Это
может быть осуществлено при принудительном
расширении газа.
В
соответствии с
формулой (2.100) при ![]() величины
величины ![]() и
и ![]() имеют
различные знаки, и с ростом объёма газа
его температура, а, следовательно, и
внутренняя энергия, уменьшаются. С этим,
в частности, связано понижение температуры
идеального газа при его адиабатическом
расширении, так как в этом процессе
имеют
различные знаки, и с ростом объёма газа
его температура, а, следовательно, и
внутренняя энергия, уменьшаются. С этим,
в частности, связано понижение температуры
идеального газа при его адиабатическом
расширении, так как в этом процессе ![]() .
Наоборот, при
.
Наоборот, при ![]() с
ростом объёма газа его температура
растёт. В соответствии с первым началом
термодинамики этот рост должен быть
обеспечен подводом к системе дополнительного
количества теплоты.
с
ростом объёма газа его температура
растёт. В соответствии с первым началом
термодинамики этот рост должен быть
обеспечен подводом к системе дополнительного
количества теплоты.
Рассуждая
аналогичным образом, можно на основании
формулы (2.102) установить
связь между приращениями давления и
температуры. При![]() с
ростом давления температура газа будет
возрастать, а при
с
ростом давления температура газа будет
возрастать, а при ![]() -
уменьшаться.
-
уменьшаться.
Работа газа в политропическом процессе может быть определена с помощью интеграла (1.13) при подстановке в него уравнения политропы(2.107), аналогично тому, как это сделано в формуле (2.97):
|
|
(2.112) |
Интегрирование в выражении (2.112) дает формулу для определения работы в политропическом процессе
|
|
(2.113) |
где: ![]() и
и ![]() -
начальные давление и объём газа,
-
начальные давление и объём газа, ![]() -
его конечный объём.
-
его конечный объём.
Из этой формулы, в частности, следует, что работа при расширении газа всегда остаётся положительной, независимо от того, какое значение принимает показатель политропы, больше или меньше единицы.
Нетрудно
видеть, что для адиабатического процесса
при ![]() выражение (2.113) переходит
в формулу (2.95).
Для изобарического процесса, при
выражение (2.113) переходит
в формулу (2.95).
Для изобарического процесса, при ![]() ,
выражение (2.113) дает
,
выражение (2.113) дает
|
|
(2.114) |
где
учтено, что при этом процессе ![]() .
.
Формула (2.113) неприменима
для описания изохорического процесса,
так как при выводе уравнения
политропы (2.103) исключался
случай ![]() .
Но из формулы (2.100) очевидно,
что работа газа в изохорическом процессе
равна нулю.
.
Но из формулы (2.100) очевидно,
что работа газа в изохорическом процессе
равна нулю.
Другим
процессом, не описывающимся
соотношением (2.113),
является изотермический процесс. Как
было сказано выше, он является предельным
случаем политропического процесса
при ![]() .
Работу в изотермическом процессе можно
найти, если в формулу (2.112) в
соответствии с законом Бойля-Мариотта
подставить
.
Работу в изотермическом процессе можно
найти, если в формулу (2.112) в
соответствии с законом Бойля-Мариотта
подставить ![]() ,
а затем выполнить интегрирование. Тогда
имеем
,
а затем выполнить интегрирование. Тогда
имеем
|
|
(2.115) |
или
|
|
(2.116) |
где
учтено постоянство температуры в этом
процессе: ![]() .
.
Поскольку
внутренняя энергия идеального газа не
изменяется в изотермическом процессе,
количество теплоты, полученное газом,
также может быть рассчитано по этой
формуле, то есть в этом процессе ![]() .
При изотермическом расширении идеального
газа работа совершается только за счёт
теплоты, подведённой из окружающей
среды.
.
При изотермическом расширении идеального
газа работа совершается только за счёт
теплоты, подведённой из окружающей
среды.
В заключение параграфа запишем все полученные формулы в единую таблицу 2.1.
|
Термодинамический процесс |
Показательполитропы |
Теплоемкость |
Работа |
|
Изотермический |
1 |
|
|
|
Изобарический |
0 |
|
|
|
Изохорический |
|
|
0 |
|
Адиабатический |
|
0 |
|
Задача
2.4. Какова молярная теплоёмкость ![]() одноатомного
газа и показатель политропы
одноатомного
газа и показатель политропы ![]() для
процесса, в котором работа, совершаемая
газом, в два раза превосходит количество
теплоты, передаваемое ему?
для
процесса, в котором работа, совершаемая
газом, в два раза превосходит количество
теплоты, передаваемое ему?
Решение:
Так как по условию задачи ![]() ,
то в соответствии с первым началом
термодинамики имеем:
,
то в соответствии с первым началом
термодинамики имеем:
![]()
или
![]() .
.
Тогда,
с учетом одноатомности газа (число
степеней свободы ![]() ),
молярную теплоемкость можно определить
по формуле:
),
молярную теплоемкость можно определить
по формуле:
![]() ,
,
а показатель политропы соответственно будет равен:
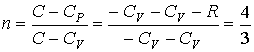
Задача
2.5. Какая работа совершается одним молем
идеального газа в политропическом
процессе с показателем политропы ![]() при
изменении температуры газа на
при
изменении температуры газа на ![]() ?
?
Решение:
Используя уравнение политропы (2.108): ![]() и
уравнение Клапейрона-Менделеева для
одного моля
и
уравнение Клапейрона-Менделеева для
одного моля ![]() ,
перепишем (2.113) в
виде:
,
перепишем (2.113) в
виде:
 .
.
Отсюда имеем:
![]() .
.
Следовательно, работа, совершаемая одном молем идеального газа в процессе с постоянной теплоёмкостью, определяется только разностью температур конечного и начального состояний газа.
Таким образом, для идеального газа работа, а, следовательно, и количество теплоты, в политропических процессах определяются только конечным и начальным состояниями системы, так как путь перехода из одного состояния в другое определён теплоёмкостью газа (показателем политропы). Однако даже при рассмотрении только политропических процессов, работу и количество теплоты нельзя считать функцией состояния системы, так как переход из одного состояния в другое может быть осуществлен последовательностью различных политропических процессов.
Задача 2.6. Какое количество теплоты передано одноатомному газу в процессе, описанному в условии задачи 2.5?
Решение: В соответствии с формулой (2.105) имеем:
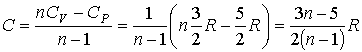 .
.
Тогда количество теплоты будет равно:
 .
.
Отсюда,
в частности, следует, что при равенстве
показателя политропы показателю адиабаты
для одноатомного газа: ![]() ,
количество теплоты
,
количество теплоты ![]() .
.
Работа идеального газа в изопроцессах.
Первый закон термодинамики (закон сохранения энергии для тепловых процессов) определяет количественное соотношение между изменением внутренней энергии системы дельта U, количеством теплоты Q, подведенным к ней, и суммарной работой внешних сил A, действующих на систему.
Первый закон термодинамики - Изменение внутренней энергии системы при ее переходе из одного состояния в другое равно сумме количества теплоты, подведенного к системе извне, и работы внешних сил, действующих на нее:
![]()
Первый закон термодинамики - количество теплоты, подведенное к системе, идет на изменение ее внутренней энергии и на совершение системой работы над внешними телами:
![]()
Частные случаи первого закона термодинамики для изопроцессов
При изохорном процессе объем газа остается постоянным, поэтому газ не совершает работу. Изменение внутренней энергии газа происходит благодаря теплообмену с окружающими телами:
![]()
При изотермическом процессе количество теплоты, переданное газу от нагревателя, полностью расходуется на совершение работы:
Q=A'
При изобарном расширении газа подведенное к нему количество теплоты расходуется как на увеличение его внутренней энергии и на совершение работы газом:
![]()
Адиабатный процесс - термодинамический процесс в теплоизолированной системе.
![]()
Адиабатический процесс.
Адиабатический процесс — термодинамический процесс в макроскопической системе, при котором система не получает и не отдаёт тепловой энергии.
Для
адиабатического процесса первое начало
термодинамики в силу отсутствия
теплообмена системы со средой имеет
вид: ![]() ,
, ![]() -
изменение внутренней энергии тела, A -
работа, совершаемая системой
-
изменение внутренней энергии тела, A -
работа, совершаемая системой

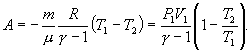
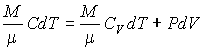 ,
, .
.
 .
. ,
,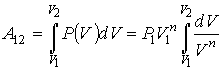 .
.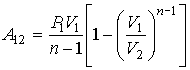 ,
,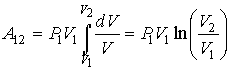
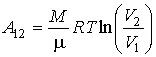 ,
,