
- •3. Основные закономерности химических процессов.
- •3.1 Основные понятия и законы химической термодинамики
- •Однородная система – одинаковые химические и физические свойства во всех частях системы.
- •Термическое равновесие (все части системы находятся при одинаковой температуре) есть необходимое условие термодинамического равновесия.
- •3. 2. Характеристические функции
- •3.3. Критерии возможности и направленности самопроизвольного процесса и условия равновесия
- •3.4. Основные термодинамические функции индивидуальных веществ
- •3.5. Термодинамические функции реакций
- •3.5.1. Зависимость теплового эффекта реакции от температуры
- •3.7. Энергия Гиббса смеси. Химический потенциал компонента
- •3.8. Термодинамический закон действующих масс (тздм)
- •3.9. Направление протекания химической реакции. Использование термодинамического закона действующих масс для расчета состава равновесной смеси
- •3.10. Влияние температуры и давления на химическое равновесие
- •3.11. Химическое равновесие в гетерогенных системах.
- •3.12. Химическая кинетика
- •3.13. Константы скоростей химических реакций
- •3.14. Теория (модель) активированного комплекса
- •3.15. Химическая кинетика в гетерогенных системах
- •Выделяют следующие стадии гетерогенного катализа:
3.4. Основные термодинамические функции индивидуальных веществ
Количество тепла, принимаемое молем вещества, при повышении его температуры на 1 градус, называется его мольной теплоемкостью, соответственно при постоянном объеме или при постоянном давлении
![]() ,
,
![]() .
(3.19)
.
(3.19)
Непосредственное использование 1-го начала термодинамики в форме (3.2') показывает, что CV связана с изменением внутренней энергии. Дифференциал энтальпии Н = U + P·V при постоянном давлении (dH)Р = dU + P·dV = (δQ)Р сопоставленный с (3.2') показывает, что CР взаимосвязана с изменением энтальпии.
Вытекающая из последнего соотношения взаимосвязь мольных теплоемкостей при постоянном давлении и постоянном объеме для газов (верхняя строка в (3.20)) легко устанавливается с использованием мольного уравнения Менделеева-Клапейрона.
![]() (3.20)
(3.20)
Для твердых тел (нижняя строка) эта взаимосвязь выражается через молярный объем при 0 К (V0), изобарический коэффициент термического расширения (α) и изотермический коэффициент сжимаемости твердого тела (β).
Энтальпия нагревания вещества при изменении температуры от Т1 до Т2 − результат интегрирования CР (3.19):
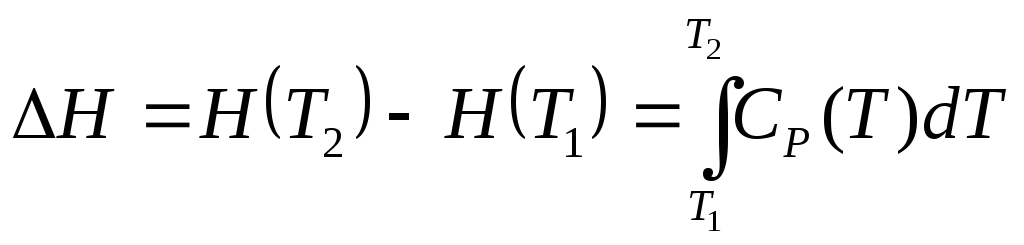 .
(3.21)
.
(3.21)
Температурное изменение энтропии при постоянном давлении следует из исходных определений энтропии (3.3) и теплоемкости CР:
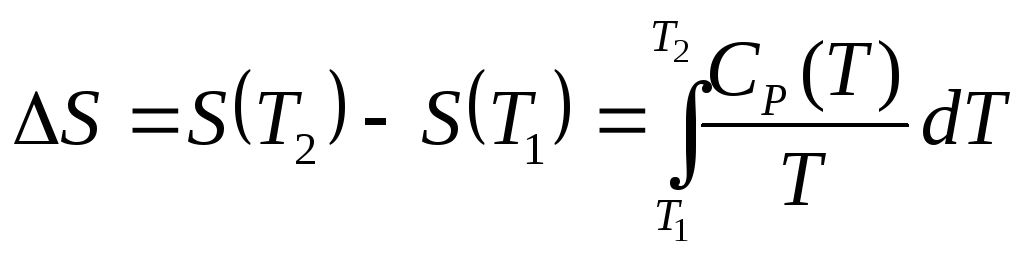 .
(3.21')
.
(3.21')
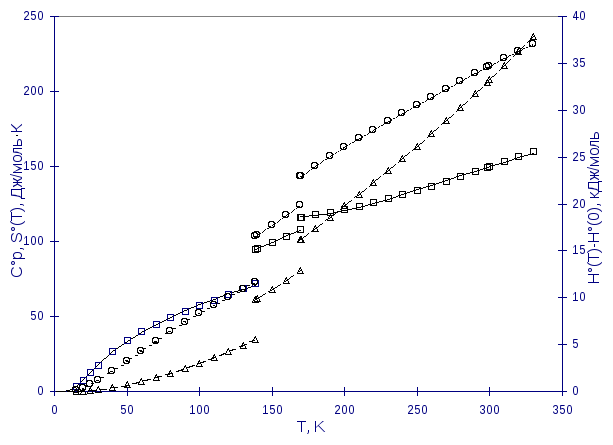
На рисунке приведен результат калориметрических измерений теплоемкости (квадратики) циклогексена - исходной функции для расчета энтальпии (кружочки) и энтропии (треугольники).
Термохимия
(термодинамический
раздел химии), кроме теплоемкости,
занимается определением температур Tk
и
теплот
![]() фазовых
и полиморфных превращений.
фазовых
и полиморфных превращений.
При наличии такой информации основные (наиболее используемые) термодинамические функции рассчитываются по формулам
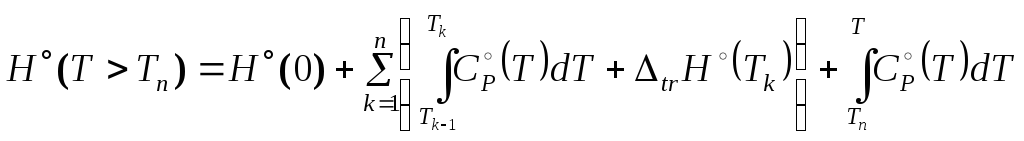 ,
(3.23)
,
(3.23)
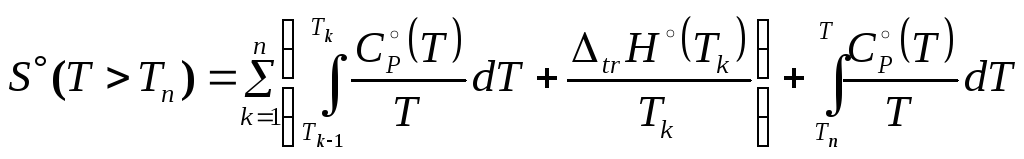 .
(3.24)
.
(3.24)
Дополненные стандартными энтальпиями образования (см. далее) они составляют основу термодинамических банков данных.
3.5. Термодинамические функции реакций
Предваряя анализ тепловых эффектов химических реакций, ещё раз остановимся на символьном уравнении химической реакции
|
ν'1 A1 + ν'2 A2 = ν3 A3 + ν4 A4. (3H2 + N2 = 2NH3) (3.25') |
|
Δn1 = − ν'1·ξ , Δn2 = − ν'2·ξ , Δn3 = + ν3·ξ , Δn4 = + ν4 ξ . (3.26') |
Реагенты в уравнении реакции, естественно, со сменой знака перенесём в правую часть
0 = ν1 A1 + ν2 A2 + ν3 A3 + ν4 A4. (0 = −3H2 −N2 + 2NH3).
Стехиометрические коэффициенты для реагентов при этом следует считать отрицательными: (ν1 = - ν'1, ν2 = - ν'2). Компактное и математически изящное уравнение химической реакции из произвольного числа компонентов принимает вид:
0 = Σ νi Ai , νi < 0 для реагентов. (3.25)
Все текущие, в том числе и конечные количества реагентов и продуктов реакции единообразно выражаются через реакционную переменную ξ,:
Δni = νi ξ , ni = n0i + νi ξ . (3.26)
Изменение числа молей при протекании реакции пропорционально стехиометрическому коэффициенту – закон кратных отношений.
Если реакция происходит при постоянном объеме V, то указанный закон будет действовать и для концентраций (Ci = ni/(V, л)) − молярности). Разделив (3.26) на V получим
ΔСi = νi ξ', Сi = С0i + νi ξ' , где ξ' = ξ/ V (3.26')
Закон сохранения массы для реакции (3.25) с использованием соотношений (3.26) 0 = ΣΔmi = Σ( MiΔni) = ξ Σ( Mi νi ) сводится к равной нулю стехиометрической сумме мольных масс Mi: Σ Mi νi = 0.
Реакции синтеза аммиака 3H2 + N2 = 2NH3 соответствует менее привычная для химиков (1) (2) (3)
форма (3.25): 0 = −3H2 − N2 + 2NH3. Убывающим по реакции веществам соответствуют отрицательные стехиометрические коэффициенты, а прибывающим – положительные. В частности, исходному «стехиометрическому» составу n01 =3 моль, n02 =1 моль, n03 =0 моль при «полном, 100%-ном» завершении реакции соответствует ξ=1 моль (последняя строка нижеследующей таблички).
Таблица. Три задачки
|
1 |
2 |
3 |
|
1 |
2 |
3 |
|
(3.26): n0i = ni - νi ξ |
ξ=(ni - n0i)/νi |
(3.26): ni = n0i + νi ξ | ||||
|
5 |
1 |
10 |
(0-1)/(-1)=1 |
5-3*1=2 |
0 |
10+2*1=12 |
|
4+3*2=10 |
4+2=6 |
0 |
(4-0)/2=2 |
4 |
4 |
4 |
|
3 |
1 |
0 |
(2-0)/2=1 |
3-3*1=0 |
1-1=0 |
2 |
Исходные данные выделены жирным шрифтом.
Изменение химического и фазового состава системы при протекании реакции влечет за собой изменение ее термодинамических характеристик и свойств.
Текущее изменение энтальпии
![]() (3.27)
(3.27)
![]() (3.28)
(3.28)
выражается через стехиометрически определенную энергетическую характеристику реакции – энтальпию реакции r H.
При определении энтальпии химического соединения Hi необходимо выбрать уровень ее отсчета. Для этой цели используется функция
![]() ,
(3.29)
,
(3.29)
которая в теплотехнической литературе получила название полной энтальпии. Кроме энтальпии нагревания от T0 до T (в квадратных скобках) она выражена через энтальпию образования химического соединения из простых веществ при T0.
Комиссия ИЮПАК по термодинамике определила (1975 г.) в качестве основного стандартного состояния для газообразных веществ простое вещество в состоянии идеального газа с давлением Рº = 1 атм при любой фиксированной температуре. Для твердых и жидких веществ основное стандартное состояние – это состояние чистого вещества, находящееся под давлением Рº = 1 атм. Если специально не оговорено, принято T0 = 298,15 К.
Все стандартные значения отмечаются маленьким кружочком в позиции верхнего индекса с указанием температуры в скобках.
Стандартная
энтальпия реакции
общего
вида 0
= Σ
νi
Ai
из
формул (3.28), (3.29) выражается через
стандартные энтальпии образования
реагентов и продуктов
![]() .
(3.30)
.
(3.30)
Пример: CH4 + CO2 = 2 CO + 2 H2.
rH(298) = -(-74,85) - (-393,51) + 2(-110,5) + 2(0) = 247,36 кДж/моль
В свою очередь, fH(298) химического соединения – это rH(298) образования моля этого соединения из простых веществ.
Например:
C, графит + 1/2 O2 = CO, fH(298) = –110,54 кДж/моль
H2 + 1/2 O2 = H2O, ж fH(298, ж) = –285,84 КДж/моль
