
- •Министерство образования Российской Федерации
- •Введение
- •Используемые единицы измерений и основные константы
- •. Строение атома
- •. Предпосылки возникновения волновой механики
- •1.1.1.Корпускулярно-волновая природа электромагнитного излучения
- •1.1.2. Теория строения атома Бора
- •1.1.3. Корпускулярно-волновой дуализм свойств материи
- •1.1.4. Принцип неопределенности
- •. Волновая (квантовая) механика
- •1.2.1.Волновое уравнение. Уравнение Шредингера
- •1.2.2.Решение уравнения Шредингера для простейших случаев
- •2. Распределение вероятности нахождения электрона в объеме потенциального ящика (плотность вероятности) определяется его энергетическим состоянием – энергией, которой обладает электрон.
- •1. Энергия электрона в трехмерном потенциальном ящике квантована.
- •2. Каждое энергетическое состояние электрона определяется набором из трех квантовых чисел.
- •. Квантово-механическая модель атома
- •1.3.1. Основное состояние атома водорода
- •1.3.2. Радиальное распределение электронной плотности. Электронная орбиталь
- •1.3.3.Возбужденные состояния атома водорода
- •1.3.4. Многоэлектронные атомы
- •1.3.5. Электронные конфигурации многоэлектронных атомов
- •1.3.6.Связь периодического закона со строением атома
- •1.3.7.Физико-химические характеристики атома
- •. Химическая связь
- •. Основные характеристики химической связи. Классификация моделей описания химической связи
- •2.1.1.Основные параметры химической связи
- •2.1.2.Типы химической связи
- •2.2. Ковалентная химическая связь
- •2.2.1. Метод валентных связей (вс)
- •Пример. Энергия и длина связи в молекуле водорода, определенные экспериментально и рассчитанные с учетом различных факторов:
- •2.2.2.Кратные связи.- и-связи
- •Пример. Характеристики химических связей различной кратности:
- •2.2.3. Геометрия простейших молекул. Гибридизация ао
- •Примеры различных случаев гибридизации.
- •2.2.4. Донорно-акцепторный механизм образования ковалентной связи
- •2.2.5.Метод молекулярных орбиталей (мо)
- •Пример 1. Распределение валентных электронов по мо молекул и молекулярных ионов элементов первого периода.
- •2.3. Полярность связи. Дипольный момент молекулы
- •Пример.
- •. Химическая связь в твердых веществах и жидкостях
- •. Агрегатные состояния
- •Температуры (с), энтальпия (н0, кДж/моль) и энтропии (s0, Дж/мольк) фазовых переходов некоторых веществ при атмосферном давлении
- •.Межмолекулярное взаимодействие
- •3.2.1.Межмолекулярные взаимодействия (силы Ван-дер-Ваальса)
- •Относительный вклад каждой составляющей в энергию межмолекулярного взаимодействия для различных молекул
- •3.2.2.Водородная связь
- •Примеры.
- •.Химическая связь в твердом теле
- •3.3.1.Основные понятия о строении кристаллов
- •3.3.2.Молекулярные кристаллы
- •3.3.3.Ковалентные (атомные) кристаллы
- •3.3.4.Ионные кристаллы. Ионный тип химической связи
- •Энергия кристаллической решетки, рассчитанная по уравнению Борна, из термодинамики и измеренная экспериментально
- •3.3.5.Металлические кристаллы. Металлическая химическая связь
- •3.3.6.Зонная модель кристаллического тела
- •3.3.7.Металлы, полупроводники и диэлектрики
- •3.3.8.Кристаллические материалы
- •Собственные дефекты:
- •3.3.9.Аморфныетвердые тела
- •.Химическая связь в жидкостях
- •3.4.1.Жидкое состояние вещества
- •3.4.2.Жидкие кристаллы
- •Библиографический список
- •Основы общей химии
- •Часть 1. Строение вещества
- •190005, С-Петербург, 1-я Красноармейская ул., д.1
1.2.2.Решение уравнения Шредингера для простейших случаев
Решение уравнения Шредингера даже для относительно простых реальных объектов, таких как атомы и молекулы, содержащих два и более электронов, изучаемых в теории строения атома и химической связи, представляет собой сложную математическую задачу. Для того чтобы понять характер и особенности результатов квантово-механического описания состояния электрона в атомах и молекулах, решим строго простейшую задачу нахождения электрона в так называемом "потенциальном ящике" – некоторой ограниченной области пространства, вне которой потенциальная энергия электрона обращается в бесконечность. Электрон не может покинуть пределы "потенциального ящика", то есть находится в связанном состоянии. Это, по сути своей, является моделью нахождения электрона в атоме.
Электрон в одномерном потенциальном ящике.
Р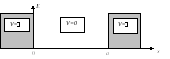 ассмотрим
состояние электрона в одномерном
потенциальном ящике (рис. 1.3). Движение
электрона происходит только вдоль осиX.
Внутри ящика потенциальная энергия
частицы принимается равной нулю
(потенциальную энергию можно отсчитывать
от любого выбранного уровня), вне его
она равна бесконечности, то есть частица
находится внутри ящика и не может
покинуть его пределы.
ассмотрим
состояние электрона в одномерном
потенциальном ящике (рис. 1.3). Движение
электрона происходит только вдоль осиX.
Внутри ящика потенциальная энергия
частицы принимается равной нулю
(потенциальную энергию можно отсчитывать
от любого выбранного уровня), вне его
она равна бесконечности, то есть частица
находится внутри ящика и не может
покинуть его пределы.
Рис. 1.3. Электрон в одномерном потенциальном ящике: a - параметр (размер)
потенциального ящика
С точки зрения классической механики частица, находящаяся в потенциальном ящике, может иметь в принципе любую энергию и находиться в любой точке ящика. При квантово-механическом рассмотрении ситуация меняется. Состояние электрона описывается уравнением Шредингера, и его характеристики (энергия и вероятность нахождения в пространстве) получаются при решении этого уравнения.
Как и любое дифференциальное уравнение, уравнение Шредингера имеет бесконечное множество решений. Физический смысл имеют лишь некоторые из них. В нашем случае волновая функция описывает реальную физическую систему, поэтому она должна соответствовать следующим условиям:
конечность – вероятность нахождения электрона в пространстве не может быть больше единицы;
однозначность – вероятность нахождения электрона в точке однозначна;
непрерывность – нет особых точек в пространстве.
Волновые функции, удовлетворяющие этим условиям, называются собственными функциями, а соответствующие им значения энергий – собственными значениями энергий.
Поскольку электрон находится внутри одномерного «ящика» (V=0), уравнение Шредингера приобретает вид
![]() .
.
Известно,
что решением данного типа уравнения
может быть функция
![]() – общее решение. В принципе вид функции
может быть и другим, но она должна быть
непрерывной, однозначной и конечной.
– общее решение. В принципе вид функции
может быть и другим, но она должна быть
непрерывной, однозначной и конечной.
Используя общее решение, граничные условия нашей задачи и принцип нормировки, можно получить волновую функцию, описывающую состояние электрона в потенциальном ящике.
Граничными условиями является равенство волновой функции нулю на стенках:
![]() ,
,
![]() .
.
Поскольку амплитуда волновой функции не равна нулю, то из второго условия следует:
![]() ,
,
![]() ,n=1,2,3…..,
,n=1,2,3…..,
![]() ,
,![]() .
.
Значение амплитуды А находят из условия нормировки. Поскольку электрон находится в потенциальном ящике, то интеграл квадрата волновой функции по координате ящика (от 0 до a) равен единице:
![]() ,
,
![]() ,
,![]() ,
,
![]() ,
,
![]() ,
,


при x=0 и x=a =0
![]()
![]() .
.
Таким образом, выражение для волновой функции электрона в одномерном потенциальном ящике имеет вид
![]() ,
,
где a – параметр потенциального ящика; n = 1,2,3…– целочисленный параметр. То есть состоянию электрона в потенциальном ящике соответствует набор волновых функций, отличающихся целочисленным параметром n, называемым квантовым числом.
Для определения энергии электрона проделаем следующие математические операции.
1. Поскольку в уравнение Шредингера входят волновая функция, и ее вторая производная, запишем их:
![]() ,
,
![]() ,
,
![]() .
.
2. Подставим выражения волновой функции и ее второй производной в уравнение Шредингера, описывающее состояние электрона внутри потенциального ящика:
![]() ,
,
![]() .
.
3. Поскольку волновая функция внутри ящика не равна нулю:
(![]() ),
то
),
то![]() ,
,
![]() ,
n=1,2,3…
,
n=1,2,3…
То есть набору волновых функций соответствует набор энергий.
Из полученных результатов решения следуют особенности квантово-механического описания состояния электрона в потенциальном ящике.
1. Электрон, находясь в потенциальном ящике, может иметь только дискретные значения полной энергии E1, E2, E3…, величины которых определяет целочисленный параметр n = 1,2,3…, называемый квантовым числом. То есть энергия связанного электрона квантована.
