
- •Министерство образования Российской Федерации
- •Введение
- •Используемые единицы измерений и основные константы
- •. Строение атома
- •. Предпосылки возникновения волновой механики
- •1.1.1.Корпускулярно-волновая природа электромагнитного излучения
- •1.1.2. Теория строения атома Бора
- •1.1.3. Корпускулярно-волновой дуализм свойств материи
- •1.1.4. Принцип неопределенности
- •. Волновая (квантовая) механика
- •1.2.1.Волновое уравнение. Уравнение Шредингера
- •1.2.2.Решение уравнения Шредингера для простейших случаев
- •2. Распределение вероятности нахождения электрона в объеме потенциального ящика (плотность вероятности) определяется его энергетическим состоянием – энергией, которой обладает электрон.
- •1. Энергия электрона в трехмерном потенциальном ящике квантована.
- •2. Каждое энергетическое состояние электрона определяется набором из трех квантовых чисел.
- •. Квантово-механическая модель атома
- •1.3.1. Основное состояние атома водорода
- •1.3.2. Радиальное распределение электронной плотности. Электронная орбиталь
- •1.3.3.Возбужденные состояния атома водорода
- •1.3.4. Многоэлектронные атомы
- •1.3.5. Электронные конфигурации многоэлектронных атомов
- •1.3.6.Связь периодического закона со строением атома
- •1.3.7.Физико-химические характеристики атома
- •. Химическая связь
- •. Основные характеристики химической связи. Классификация моделей описания химической связи
- •2.1.1.Основные параметры химической связи
- •2.1.2.Типы химической связи
- •2.2. Ковалентная химическая связь
- •2.2.1. Метод валентных связей (вс)
- •Пример. Энергия и длина связи в молекуле водорода, определенные экспериментально и рассчитанные с учетом различных факторов:
- •2.2.2.Кратные связи.- и-связи
- •Пример. Характеристики химических связей различной кратности:
- •2.2.3. Геометрия простейших молекул. Гибридизация ао
- •Примеры различных случаев гибридизации.
- •2.2.4. Донорно-акцепторный механизм образования ковалентной связи
- •2.2.5.Метод молекулярных орбиталей (мо)
- •Пример 1. Распределение валентных электронов по мо молекул и молекулярных ионов элементов первого периода.
- •2.3. Полярность связи. Дипольный момент молекулы
- •Пример.
- •. Химическая связь в твердых веществах и жидкостях
- •. Агрегатные состояния
- •Температуры (с), энтальпия (н0, кДж/моль) и энтропии (s0, Дж/мольк) фазовых переходов некоторых веществ при атмосферном давлении
- •.Межмолекулярное взаимодействие
- •3.2.1.Межмолекулярные взаимодействия (силы Ван-дер-Ваальса)
- •Относительный вклад каждой составляющей в энергию межмолекулярного взаимодействия для различных молекул
- •3.2.2.Водородная связь
- •Примеры.
- •.Химическая связь в твердом теле
- •3.3.1.Основные понятия о строении кристаллов
- •3.3.2.Молекулярные кристаллы
- •3.3.3.Ковалентные (атомные) кристаллы
- •3.3.4.Ионные кристаллы. Ионный тип химической связи
- •Энергия кристаллической решетки, рассчитанная по уравнению Борна, из термодинамики и измеренная экспериментально
- •3.3.5.Металлические кристаллы. Металлическая химическая связь
- •3.3.6.Зонная модель кристаллического тела
- •3.3.7.Металлы, полупроводники и диэлектрики
- •3.3.8.Кристаллические материалы
- •Собственные дефекты:
- •3.3.9.Аморфныетвердые тела
- •.Химическая связь в жидкостях
- •3.4.1.Жидкое состояние вещества
- •3.4.2.Жидкие кристаллы
- •Библиографический список
- •Основы общей химии
- •Часть 1. Строение вещества
- •190005, С-Петербург, 1-я Красноармейская ул., д.1
1.3.7.Физико-химические характеристики атома
Физико-химические характеристики атома, такие как энергия ионизации, энергия сродства к электрону, электроотрицательность, атомные и ионные радиусы, позволяют объяснять и предсказывать некоторые химические свойства элементов. Эти характеристики закономерно изменяются с ростом заряда ядра атомов и подобны для элементов с повторяющимися электронными структурами.
1. Радиус атома и иона. Поскольку атомы и ионы не имеют четкой геометрической границы, невозможно выделить и измерить отдельный атом. Эти характеристики рассчитывают исходя из предположения, что атомы и ионы в соединениях, кристаллах и т.д. представляют собою твердые шары, которые упакованы плотнейшим образом.
Ковалентный радиус – половина экспериментально определяемого расстояния между ядрами двух одинаковых атомов, образовавших простую ковалентную молекулу (рис. 1.20).
П ример.
Длина химической связи (расстояние
между ядрами атомов) в молекуле H2
составляет величину rсв=
0,74 Ǻ, следовательно, ковалентный радиус
равен:
ример.
Длина химической связи (расстояние
между ядрами атомов) в молекуле H2
составляет величину rсв=
0,74 Ǻ, следовательно, ковалентный радиус
равен:
![]() .
.
Ионный радиус рассчитывают из экспериментально определяемых параметров кристаллической решетки, но расчет более сложен, так как размеры катионов и анионов разные.
Общие закономерности:
в периоде радиус атома уменьшается (увеличение заряда ядра приводит к сжатию орбиталей). В группе радиус увеличивается с увеличением числа электронных слоев (рис. 1.21);
катион по сравнению с атомом имеет меньший радиус, а анион больший:
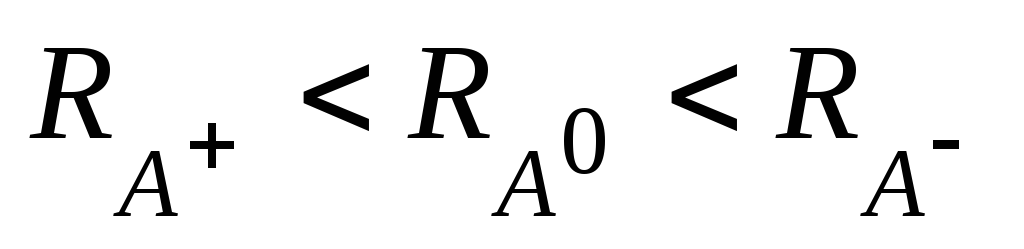 .
.
Пример.
|
Частица |
Na0 |
Na+ |
Sr0 |
Sr+2 |
Cl0 |
Cl- |
S0 |
S-2 |
|
Радиус в Ǻ |
1,54 |
1,02 |
1,91 |
1,18 |
0,99 |
1,81 |
1,02 |
1,84 |
2.
Энергия ионизации
(Eи)
– энергия, которую необходимо приложить
к нейтральному невозбужденному атому
для удаления электрона на бесконечность:![]() А0
– е
А+.
А0
– е
А+.


Рис. 1.21. Зависимость атомного радиуса от заряда ядра
Энергия ионизации в многоэлектронном атоме может быть определена для каждого электрона. Первая энергия ионизации – удаление электрона из нейтрального атома, вторая – отрыв электрона от однозарядного иона и т. д. Теоретически сколько электронов в атоме, столько и энергий ионизации: (Еи)n+1 > (Еи)n.
Энергия ионизации характеризует энергию связи электрона в атоме.
Общие закономерности изменения первой энергии ионизации элементов:
в периоде энергия ионизации увеличивается, но не монотонно. Атомы, имеющие полностью или наполовину заполненные энергетические состояния, имеют большее значение энергии ионизации, электрон связан сильнее;
в
 группе энергия ионизация падает
вследствие увеличения радиуса атома
и соответственно уменьшения энергии
связи (рис. 1.22).
группе энергия ионизация падает
вследствие увеличения радиуса атома
и соответственно уменьшения энергии
связи (рис. 1.22).
Рис. 1.22. Зависимость первой энергии ионизации атомов от заряда ядра
3
He Ne Ar Kr Zn
Экспериментально энергия сродства к электрону определена примерно для 20 элементов, расположенных в основном в правой верхней части периодической таблицы. Для остальных элементов приводятся расчетные величины (термодинамические или квантово-механические расчеты).
В периоде энергия сродства к электрону
увеличивается, а в группе уменьшается,
хотя эти закономерности выглядят не
так явно, как для энергии ионизации
(рис. 1.23).
периоде энергия сродства к электрону
увеличивается, а в группе уменьшается,
хотя эти закономерности выглядят не
так явно, как для энергии ионизации
(рис. 1.23).
Рис. 1.23. Зависимость энергии сродства к электрону от заряда ядра атомов
4. Электроотрицательность – это характеристика элемента, показывающая способность атома притягивать к себе электронную плотность при образовании химической связи с другим элементом. Она позволяет оценивать вероятность распределения электронной плотности в молекулах химических соединений. Чем больше разница величин электроотрицательности атомов, образующих химическую связь, тем больше сдвигается электронная плотность к атому с большим значением электроотрицательности.
Разработано несколько способов оценки электроотрицательности атомов. Величина электроотрицательности атомов в различных шкалах может существенно различаться, поэтому сравнение величин необходимо проводить в одной шкале. Наиболее распространенными способами оценки электроотрицательности атомов являются следующие.
1.
Электроотрицательность по Малликену
(Mulliken) – полусумма энергии ионизации и
энергии сродства к электрону:![]() .
.
Данный метод имеет наиболее ясный физический смысл, поскольку в основу его положены экспериментально определяемые величины, характеризующие связь электрона с атомом. Однако употребление электроотрицательностей по Малликену ограничено из-за трудности получения достоверных значений энергии сродства к электрону для большинства элементов.
2. Электроотрицательность по Полингу (Pauling). Наибольшее распространение получила термохимическая шкала электроотрицательностей, разработанная Полингом. В данном методе электроотрицательность атомов А и В определяют исходя из энергии связи в молекулах А-В, А-А и В-В. В основу шкалы относительных значений электроотрицательностей положена электроотрицательность фтора, условно принятая равной 4,0 (F = 4,0 ).
Ниже приведены значения электроотрицательностей атомов элементов первого-третьего периода по Малликену и Полингу:
|
|
H |
Li |
Be |
B |
C |
N |
O |
F |
|
По Малликену |
7,17 |
2,96 |
2,86 |
3,83 |
5,61 |
7,34 |
9,99 |
12,32 |
|
По Полингу |
2,1 |
1,0 |
1,5 |
2,0 |
2,5 |
3,0 |
3,5 |
4,0 |
|
|
|
Na |
Mg |
Al |
Si |
P |
S |
Cl |
|
По Малликену |
|
2,94 |
2,47 |
2,97 |
4,35 |
5,72 |
7,60 |
9,45 |
|
По Полингу |
|
0,9 |
1,2 |
1,5 |
1,8 |
2,1 |
2,5 |
3,0 |
Анализ этих данных показывает, что общие закономерности изменения электроотрицательности элементов в группах и периодах Периодической системы не зависят от способа их определения. А именно: электроотрицательность в периоде растет, а в группе уменьшается. Максимальной электроотрицательностью обладают элементы, расположенные в правом верхнем углу (фтор, кислород, азот, хлор), минимальной – в левом нижнем углу (цезий, рубидий, барий) периодической таблицы.
