
- •Часть 3
- •Введение
- •1. Электрохимические процессы
- •Пример. Окисление олова ионами меди:
- •1.1. Основные понятия и определения
- •Пример. Анод – цинк, находящийся в контакте с раствором сульфата цинка; катод – медь, находящаяся в контакте с сульфатом меди:
- •1.2. Электродные процессы
- •1.2.1. Скачок потенциала на границе «металл – электролит»
- •1.2.2. Уравнение Нернста
- •1.2.3. Электроды
- •Пример. Хлорсеребряный электрод Cl-AgCl,Ag0.
- •1.2.4. Водородная шкала стандартных электродных потенциалов
- •Стандартные электродные потенциалы (0, в) и их электродные реакции
- •1.3. Неравновесные электрохимические системы
- •1.3.1. Гальванический элемент
- •1.3.2. Окислительно-восстановительные реакции в водных растворах
- •1.3.3. Электролиз
- •1.4. Кинетика электрохимических процессов
- •1.4.1. Скорость электрохимических процессов
- •1.4.2. Поляризация электродов
- •1.5. Практическое использование электрохимических процессов
- •1.5.1. Химические источники тока
- •Характеристики химических источников тока
- •Примеры.1. Марганцево-цинковый элемент.
- •1.5.2. Применение электролиза
- •2. Коррозия и защита металлов
- •2.1. Основные понятия и определения
- •2.2. Классификация коррозионных процессов
- •2.3. Химическая коррозия
- •2.3.1. Высокотемпературная газовая коррозия
- •2.3.2. Кинетика роста оксидных пленок
- •2.3.3. Факторы, влияющие на скорость газовой коррозии
- •2.4. Электрохимическая коррозия
- •2.4.1. Анодные и катодные реакции
- •Контактная коррозия металлов. Если два соприкасающихся разнородных металла контактируют с электролитом, то образуется макрогальванический коррозионный элемент.
- •2.4.2. Термодинамические условия электрохимической коррозии металлов
- •2.4.3. Факторы, влияющие на скорость электрохимической коррозии
- •2.5. Коррозионные среды и влияние дополнительных факторов
- •2.5.1. Коррозионно-механическое разрушение металлов
- •2.5.2. Водородная коррозия
- •2.5.3. Радиационная коррозия
- •Библиографический список
- •Основы общей химии. Часть 3. Электрохимические и коррозионные процессы
- •190005, С.-Петербург, 1-я Красноармейская ул., д.1
2.4. Электрохимическая коррозия
Электрохимическая коррозия металлов – коррозия, протекающая по электрохимическому механизму, – происходит в тех случаях, когда окружающая среда является электролитом. Обычно это водные растворы солей, кислот и щелочей, пленка воды с растворенными в ней газами, влага почвы и т. д. В этом случае коррозию можно представить как результат работы короткозамкнутого гальванического элемента (рис.2.5).
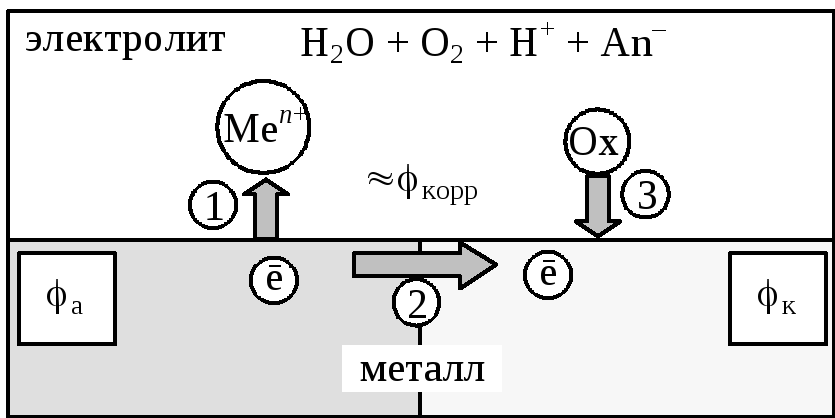
Рис.2.5. Схема коррозионной элетрохимической системы: 1- окисление поверхностных атомов металла;2– переход электронов с анодного на катодный участок;3– восстановление ионов или молекул среды
Любые неоднородности поверхности металла или контактирующего с ним электролита (локальные различая концентрации растворенных веществ) приводят к образованию участков с различным значением электродных потенциалов. Вследствие электропроводности металла образуется система короткозамкнутых гальванических элементов. На участках с меньшим значением электродного потенциала (анод) происходит окисление поверхностных атомов металла:
анод (): Ме0 Меn+ + nē
На участках с большим значением электродного потенциала (катод) происходит восстановление компонентов окружающей среды:
катод (+): Ox + nē Red
Отличительной особенностью коррозионного гальванического элемента является отсутствие внешней цепи. Электроны не выходят из корродирующего металла, а двигаются внутри него (см. рис.2.5). При этом энергия электрохимической реакции переходит только в теплоту, которая рассеивается в окружающей среде.
Анодная и катодная реакции равновероятно могут протекать в любой точке однородной поверхности металла. В этом случае коррозия называется гомогенно-электрохимической. Обычно на границе раздела «металл – электролит» существуют неоднородности поверхности металла или электролита. Это приводит к возникновению участков, на которых энергетически выгодно протекание либо анодного, либо катодного процессов. В этом случае коррозия называется гетерогенно-электрохимической.
Неоднородность системы «металл – электролит» и, как следствие, возникновение коррозионных гальванических элементов могут быть вызваны следующими причинами:
неоднородностью металла по химическому или фазовому составу (если, например, изделие состоит из деталей, изготовленных из разнородных металлов);
наличием на поверхности окисных пленок;
различием концентраций растворенных в электролите веществ на отдельных участках контакта металла с электролитом;
неодинаковой температурой различных участков металла;
механическими напряжениями в металлической детали.
Обычно анодные и катодные участки поверхности металла имеют малые размеры. При контакте металла с электролитом возникает большое число коррозионных микроэлементов, работа которых и приводит к электрохимической коррозии.
К ороткозамкнутый
гальванический элемент является
полностью поляризованной электрохимической
системой. В результате поляризации
(катода –к
и анода – а)
потенциалы анодных и катодных участков
выравниваются и приобретают значение
корр,
которое называется стационарным
потенциалом коррозии
(рис.2.6).
При этом коррозия протекает с максимальной
скоростью, соответствующей максимальной
плотности коррозионного
тока
iкорр.
ороткозамкнутый
гальванический элемент является
полностью поляризованной электрохимической
системой. В результате поляризации
(катода –к
и анода – а)
потенциалы анодных и катодных участков
выравниваются и приобретают значение
корр,
которое называется стационарным
потенциалом коррозии
(рис.2.6).
При этом коррозия протекает с максимальной
скоростью, соответствующей максимальной
плотности коррозионного
тока
iкорр.
Используя количественные соотношения при протекании электрохимических процессов, можно рассчитать массовый и глубинный показатели коррозии.
