
- •Часть 2
- •Введение
- •1.Химическая термодинамика
- •1.1.Основные понятия и определения
- •1.1.1.Термодинамическая система
- •1.1.2.Термодинамический процесс
- •1.1.3.Термодинамические функции состояния
- •1.2.Тепловые эффекты физико-химических процессов
- •1.2.1.Внутренняя энергия
- •1.2.2.Первое начало термодинамики
- •1.2.3.Тепловой эффект химической реакции
- •1.2.4.Термохимические расчеты
- •1.2.5.Зависимость теплового эффекта реакции от температуры
- •1.3. Направление и пределы протекания химического процесса
- •1.3.1.Второе начало термодинамики
- •1.3.2.Энтропия
- •1.3.3.Направление химического процесса
- •Примеры.
- •1.3.4. Химический потенциал
- •2. Кинетика химических реакций
- •2.1. Механизм химической реакции
- •2.1.1.Частицы, участвующие в химической реакции
- •Энергия диссоциации молекул веществ, находящихся в газовой фазе при гомолитическом и гетеролитическом разрыве связей
- •2.1.2.Классификация химических реакций
- •Пример.
- •2.2. Элементарная химическая реакция
- •2.2.1.Скорость химической реакции
- •2.2.2.Зависимость скорости химической реакции от концентрации реагирующих веществ
- •Пример.
- •2.2.3. Константа скорости химической реакции
- •Пример. Определим общее число столкновений молекул h2 и Cl2 в 1 см3 смеси равных объемов газов при нормальных условиях.
- •2.3.Формальная кинетика гомогенных реакций
- •2.3.1.Кинетическое уравнение необратимой реакции первого порядка
- •2.3.2. Кинетическое уравнение необратимой реакции второго порядка
- •2.3.3.Реакции нулевого и высших порядков
- •2.3.4. Зависимость скорости реакции от температуры
- •2.3.5.Определение кинетических параметров реакции
- •2.3.6.Кинетическое уравнение обратимой реакции первого порядка
- •2.4. Цепной механизм химической реакции
- •2.5. Индуцированные реакции
- •2.5.1. Фотохимические реакции
- •2.5.2.Радиационно–химические процессы
- •2.6.Макрокинетика
- •2.6.1.Гетерогенные реакции
- •2.6.2.Горение и взрыв
- •2.7.Катализ
- •2.7.1.Гомогенный катализ
- •2.7.2.Гетерогенный катализ
- •3. Химическое равновесие
- •3.1.Термодинамическое условие химического равновесия
- •3.1.1. Изобара реакции
- •3.1.2. Изотерма реакции
- •3.2. Кинетическое условие химического равновесия. Константа равновесия
- •3.3. Расчет равновесного состава газовой смеси
- •Состав (мольные доли компонентов XI) равновесной газовой смеси реакции
- •3.4. Равновесия в растворах
- •3.4.1.Растворы
- •Пример.
- •3.4.2. Электролитическая диссоциация
- •3.4.3.Ионное произведение воды. Водородный показатель
- •3.4.4.Растворы кислот и оснований
- •3.4.5.Буферные растворы
- •3.4.6. Гидролиз солей
- •3.4.7.Обменные реакции с образованием осадка
- •3.5. Фазовые равновесия
- •3.5.1. Правило фаз Гиббса
- •3.5.2.Диаграмма состояния однокомпонентной системы
- •3.5.3. Диаграмма состояния двухкомпонентной системы
- •3.5.4. Кипение и кристаллизация растворов
- •Повышение температуры кипения раствора по сравнению с чистым растворителем прямо пропорционально концентрации растворенного вещества:
- •Понижение температуры кристаллизации раствора по сравнению с чистым растворителем прямо пропорционально концентрации растворенного вещества:
- •Основы общей химии
- •Часть 2 Термодинамика и кинетика химического процесса
- •190005, С-Петербург, 1-я Красноармейская ул., д.1
3. Химическое равновесие
Одно из основных
положений химической термодинамики
гласит, что любая система стремится
прийти в состояние равновесия, в котором
будет находиться сколь угодно долго,
если на нее не оказывается внешнее
воздействие. Термодинамическим условием
равновесия при протекании
изобарно-изотермического процесса
является равенство нулю изменения
энергии Гиббса (G=0).
В этом состоянии в системе сохраняется
постоянство термодинамических параметров,
в первую очередь концентрации веществ.
Отметим, что в большинстве случаев в
результате протекания прямых и обратных
реакций в системах будут присутствовать
как продукты реакции, так и исходные
вещества. Концентрации исходных веществ
и продуктов будут постоянными при
равенстве скоростей прямой и обратной
реакций (![]() ).
Таким образом, в системе выполняются
как термодинамические, так и кинетические
условия равновесия.
).
Таким образом, в системе выполняются
как термодинамические, так и кинетические
условия равновесия.
Представления о состоянии равновесия позволяют рассчитывать концентрации веществ в системах в зависимости от других термодинамических параметров, в частности от температуры, давления и количества исходных веществ. Это дает возможность управлять сдвигом равновесия с целью обеспечить максимально возможный выход целевого продукта.
3.1.Термодинамическое условие химического равновесия
Термодинамическим условием равновесия процесса, протекающего в изобарно-изотермических условиях, является равенство нулю изменения энергии Гиббса (rG(Т)=0). При протекании реакции аA + bB = сC + dD
изменение стандартной энергии Гиббса равно:
rG0T = (cfG0C + dfG0D ) – (afG0A + bfG0B ).
Данное выражение соответствует идеальному процессу, в котором концентрации реагирующих веществ равны единице и неизменны в ходе реакции. В ходе реальных процессов концентрации реагентов меняются: концентрация исходных веществ уменьшается, а продуктов реакции увеличивается. С учетом концентрационной зависимости энергии Гиббса (см. п. 1.3.4) ее изменение в ходе реакции равно:
rGT = [c(fG0C + RTlnCC) + d(fG0D + RTlnCD)]–
– [a(fG0A + RTlnCA) + b(fG0B + RTlnCB)] =
= (cfG0 C + dfG0 D ) – (afG0 A + bfG0 B ) +
+ RT(clnCC + dlnCD – alnCA – blnCB)
rGT
=
rG0T
+ RT ,
,
где![]() – безразмерная концентрацияi-го
вещества; Xi
– мольная доля
i-го вещества;
pi
– парциальное давление
i-го вещества;
р0
= =1,013105
Па – стандартное давление; сi–
молярная концентрация
i-го вещества;
с0=1
моль/л – стандартная концентрация.
– безразмерная концентрацияi-го
вещества; Xi
– мольная доля
i-го вещества;
pi
– парциальное давление
i-го вещества;
р0
= =1,013105
Па – стандартное давление; сi–
молярная концентрация
i-го вещества;
с0=1
моль/л – стандартная концентрация.
В состоянии равновесия
rG0T
+ RT = 0,
= 0,
 .
.
Величина К0 называется стандартной (термодинамичской) константой равновесия реакции. То есть при определенной температуре Т в результате протекания прямой и обратной реакции в системе устанавливается равновесие при определенных концентрациях реагирующих веществ – равновесных концентрациях (Сi)р. Величины равновесных концентраций определяются значением константы равновесия, которая является функцией температуры, и зависит от энтальпии (rН0) и энтропии (rS0) реакции:
rG0T + RTlnK0 = 0,
 ,
, ![]() ,
,
поскольку rG0T = rН0T – ТrS0T,
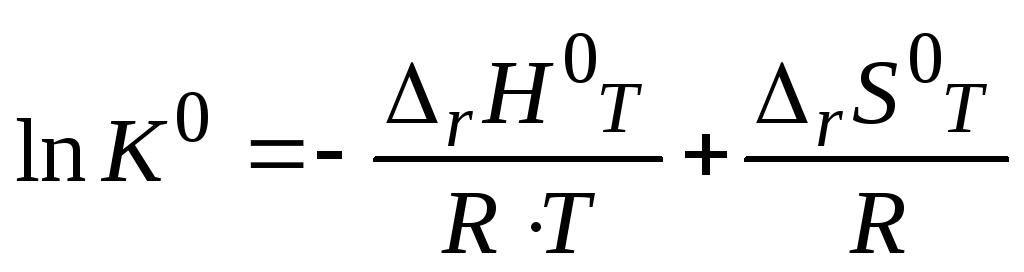 .
.
Если известны величины энтальпии (rН0T) и энтропии (rS0T) или rG0T реакции, то можно вычислить значение стандартной константы равновесия.
Константа равновесия реакции характеризует идеальные газовые смеси и растворы. Межмолекулярные взаимодействия в реальных газах и растворах приводят к отклонению расчетных величин констант равновесия от реальных. Для учета этого вместо парциальных давлений компонентов газовых смесей используется их фугитивность, а вместо концентрации веществ в растворах их активность. Фугитивность i-го компонента связана с его парциальным давлением соотношением fi = ipi, где i – коэффициент фугитивности. Активность и концентрация компонента связаны соотношением аi = iСi, где i – коэффициент активности.
Необходимо отметить, что в достаточно широкой области давлений и температур газовые смеси можно считать идеальными и проводить расчеты равновесного состава газовой смеси, считая коэффициент фугитивности i 1. В случае жидких растворов, особенно растворов электролитов, коэффициенты активности их компонентов могут значительно отличаться от единицы (i 1) и для расчета равновесного состава необходимо использовать активности.
