
- •Часть 2
- •Введение
- •1.Химическая термодинамика
- •1.1.Основные понятия и определения
- •1.1.1.Термодинамическая система
- •1.1.2.Термодинамический процесс
- •1.1.3.Термодинамические функции состояния
- •1.2.Тепловые эффекты физико-химических процессов
- •1.2.1.Внутренняя энергия
- •1.2.2.Первое начало термодинамики
- •1.2.3.Тепловой эффект химической реакции
- •1.2.4.Термохимические расчеты
- •1.2.5.Зависимость теплового эффекта реакции от температуры
- •1.3. Направление и пределы протекания химического процесса
- •1.3.1.Второе начало термодинамики
- •1.3.2.Энтропия
- •1.3.3.Направление химического процесса
- •Примеры.
- •1.3.4. Химический потенциал
- •2. Кинетика химических реакций
- •2.1. Механизм химической реакции
- •2.1.1.Частицы, участвующие в химической реакции
- •Энергия диссоциации молекул веществ, находящихся в газовой фазе при гомолитическом и гетеролитическом разрыве связей
- •2.1.2.Классификация химических реакций
- •Пример.
- •2.2. Элементарная химическая реакция
- •2.2.1.Скорость химической реакции
- •2.2.2.Зависимость скорости химической реакции от концентрации реагирующих веществ
- •Пример.
- •2.2.3. Константа скорости химической реакции
- •Пример. Определим общее число столкновений молекул h2 и Cl2 в 1 см3 смеси равных объемов газов при нормальных условиях.
- •2.3.Формальная кинетика гомогенных реакций
- •2.3.1.Кинетическое уравнение необратимой реакции первого порядка
- •2.3.2. Кинетическое уравнение необратимой реакции второго порядка
- •2.3.3.Реакции нулевого и высших порядков
- •2.3.4. Зависимость скорости реакции от температуры
- •2.3.5.Определение кинетических параметров реакции
- •2.3.6.Кинетическое уравнение обратимой реакции первого порядка
- •2.4. Цепной механизм химической реакции
- •2.5. Индуцированные реакции
- •2.5.1. Фотохимические реакции
- •2.5.2.Радиационно–химические процессы
- •2.6.Макрокинетика
- •2.6.1.Гетерогенные реакции
- •2.6.2.Горение и взрыв
- •2.7.Катализ
- •2.7.1.Гомогенный катализ
- •2.7.2.Гетерогенный катализ
- •3. Химическое равновесие
- •3.1.Термодинамическое условие химического равновесия
- •3.1.1. Изобара реакции
- •3.1.2. Изотерма реакции
- •3.2. Кинетическое условие химического равновесия. Константа равновесия
- •3.3. Расчет равновесного состава газовой смеси
- •Состав (мольные доли компонентов XI) равновесной газовой смеси реакции
- •3.4. Равновесия в растворах
- •3.4.1.Растворы
- •Пример.
- •3.4.2. Электролитическая диссоциация
- •3.4.3.Ионное произведение воды. Водородный показатель
- •3.4.4.Растворы кислот и оснований
- •3.4.5.Буферные растворы
- •3.4.6. Гидролиз солей
- •3.4.7.Обменные реакции с образованием осадка
- •3.5. Фазовые равновесия
- •3.5.1. Правило фаз Гиббса
- •3.5.2.Диаграмма состояния однокомпонентной системы
- •3.5.3. Диаграмма состояния двухкомпонентной системы
- •3.5.4. Кипение и кристаллизация растворов
- •Повышение температуры кипения раствора по сравнению с чистым растворителем прямо пропорционально концентрации растворенного вещества:
- •Понижение температуры кристаллизации раствора по сравнению с чистым растворителем прямо пропорционально концентрации растворенного вещества:
- •Основы общей химии
- •Часть 2 Термодинамика и кинетика химического процесса
- •190005, С-Петербург, 1-я Красноармейская ул., д.1
2.3.1.Кинетическое уравнение необратимой реакции первого порядка
Рассмотрим необратимую (одностороннюю) реакцию распада:
A B + D.
Кинетическое уравнение:
![]() .
.
Начальные условия: концентрация вещества А в начальный момент времени (t = 0) равна CA0.
Уравнения данного типа решаются методом разделения переменных:
![]()
![]()
![]() ,
,
![]() ,
,
при t
=
0; C
=
CA0 ![]() ,
,
![]() ,
,
![]() .
.
П оскольку
концентрация веществаА
уменьшается в ходе реакции (рис.2.4) и
асимптотически приближается к нулю,
рассчитать точно время полного превращения
вещества А
невозможно. Для оценки времени протекания
реакции используется такая характеристика,
как время
полупревращения
(полураспада)
– время, за которое прореагировала
половина исходного вещества, т. е.
концентрация вещества А
уменьшилась в два раза (
оскольку
концентрация веществаА
уменьшается в ходе реакции (рис.2.4) и
асимптотически приближается к нулю,
рассчитать точно время полного превращения
вещества А
невозможно. Для оценки времени протекания
реакции используется такая характеристика,
как время
полупревращения
(полураспада)
– время, за которое прореагировала
половина исходного вещества, т. е.
концентрация вещества А
уменьшилась в два раза (![]() ):
):
![]() –время полупревращения
(полураспада).
–время полупревращения
(полураспада).
Рис. 2.9. Изменение концентрации вещества А во времени при протекании односторонней реакции первого порядка (CA0=1)
Время полупревращения для реакций первого порядка не зависит от исходной концентрации вещества, а определяется только величиной константы скорости.
2.3.2. Кинетическое уравнение необратимой реакции второго порядка
К необратимым реакциям второго порядка относятся химические реакции типа:
A + A A2, A + B AB, A + BС AB + С.
Рассмотрим как наиболее простую первую реакцию. Ее кинетическое уравнение имеет вид
![]() .
.
Начальные условия: концентрация вещества А в начальный момент времени (t = 0) равна cA0:
![]() ,
,
 ,
,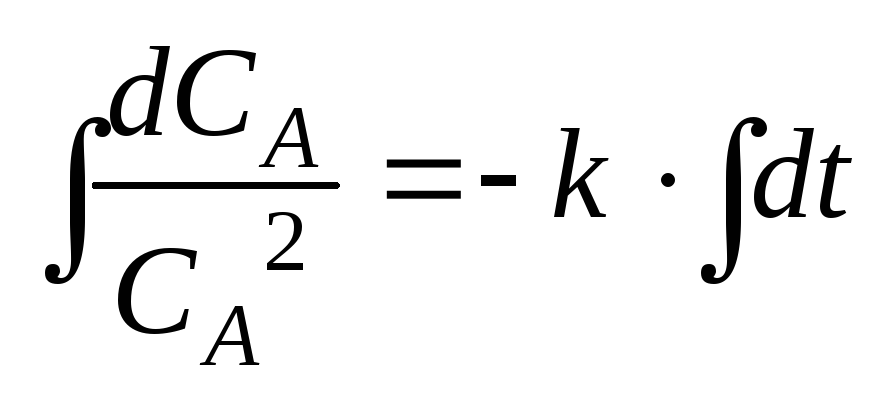 ,
,
![]() ,
,
при t
=
0;
С =
СA0
![]() ,
,![]() ,
,
![]() .
.

Р
t
Зависимость
концентрации вещества от времени для
реакций второго порядка (рис. 2.5) линейна
в координатах
![]() – t,
причем тангенс угла наклона равен
константе скорости реакции.
– t,
причем тангенс угла наклона равен
константе скорости реакции.
Время полупревращения для реакций второго порядка зависит от исходной концентрации вещества А:
![]() .
.
2.3.3.Реакции нулевого и высших порядков
Скорость реакций нулевого порядка не зависит от концентраций реагентов и определяется другими лимитирующими факторами, например площадью поверхности катализатора (в реакциях гетерогенного катализа) или поглощением света (в фотохимических реакциях):
![]() , x+
y +…=
0.
, x+
y +…=
0.
Кинетическое уравнение реакций нулевого порядка имеет вид
![]() .
.
Изменение концентрации реагирующих веществ во времени будет описываться уравнением
![]() .
.
Время полупревращения
![]() .
.
Кинетическое
уравнение реакции высших порядков имеет
вид ![]() x+y+…
2.
x+y+…
2.
2.3.4. Зависимость скорости реакции от температуры
Поскольку концентрации реагирующих веществ при постоянном объеме не зависят от температуры, то температурная зависимость скорости сложной химической реакции определяется зависимостью от температуры константы скорости. Для большинства сложных реакций эта зависимость может быть описана уравнением Аррениуса:
![]() .
.
Таким образом для реакции AA + BB = DD + EE можно записать:
![]() , где
, где
![]() .
.
Для сложных реакций энергия активации Еак, как правило, есть эффективная суммарная величина, связанная со всеми стадиями процесса. Фактически она является параметром, отражающим степень зависимости константы скорости (скорости) реакции от температуры, и обычно определяется экспериментально.
Зависимость скорости реакции от температуры можно также характеризовать температурным коэффициентом , который показывает, во сколько раз увеличивается скорость реакции при повышении температуры на 10:
![]()
![]() .
.
Температурный
коэффициент связан с энергией активации
реакции соотношением
![]() .
.
Для реакций, имеющих при температурах, не сильно отличающихся от 300 К, заметное протекание во времени (не слишком быстрых, но и не слишком медленных), энергия активации составляет величину порядка Еак 50 – 100 кДжмоль. В этих условиях температурный коэффициент 2 – 4. Эту закономерность опытным путем установил Вант–Гофф (vant Hoff): при увеличении температуры на 10С скорость химической реакции возрастает примерно в 2 – 4 раза. При помощи этого эмпирического правила Вант-Гоффа можно оценить изменение скорости реакции при изменении температуры.
Пример. Время протекания реакции АВ при температуре Т = 53С составило t=100 с (концентрация вещества А уменьшилась в 1000 раз). Сколько времени потребуется на ее протекание при 73С и 23С?
Примем, что температурный коэффициент 3. Тогда при увеличении температуры с 53С до 73С скорость реакции возрастет в 9 раз:
![]() .
.
Поскольку средняя
скорость реакции
![]() ,
то при ее увеличении время протекания
реакции уменьшится в такое же число раз
и составит величинуt=100/9
= 11,1 с. При уменьшении температуры с 53С
до 23С
скорость реакции уменьшится в 27 раз:
,
то при ее увеличении время протекания
реакции уменьшится в такое же число раз
и составит величинуt=100/9
= 11,1 с. При уменьшении температуры с 53С
до 23С
скорость реакции уменьшится в 27 раз:
![]() ,
а время протекания реакции увеличится
в такое же число раз:t=10027
=270 с.
,
а время протекания реакции увеличится
в такое же число раз:t=10027
=270 с.
