
- •Министерство образования Российской Федерации
- •Введение
- •Используемые единицы измерений и основные константы
- •. Строение атома
- •. Предпосылки возникновения волновой механики
- •1.1.1.Корпускулярно-волновая природа электромагнитного излучения
- •1.1.2. Теория строения атома Бора
- •1.1.3. Корпускулярно-волновой дуализм свойств материи
- •1.1.4. Принцип неопределенности
- •. Волновая (квантовая) механика
- •1.2.1.Волновое уравнение. Уравнение Шредингера
- •1.2.2.Решение уравнения Шредингера для простейших случаев
- •2. Распределение вероятности нахождения электрона в объеме потенциального ящика (плотность вероятности) определяется его энергетическим состоянием – энергией, которой обладает электрон.
- •1. Энергия электрона в трехмерном потенциальном ящике квантована.
- •2. Каждое энергетическое состояние электрона определяется набором из трех квантовых чисел.
- •. Квантово-механическая модель атома
- •1.3.1. Основное состояние атома водорода
- •1.3.2. Радиальное распределение электронной плотности. Электронная орбиталь
- •1.3.3.Возбужденные состояния атома водорода
- •1.3.4. Многоэлектронные атомы
- •1.3.5. Электронные конфигурации многоэлектронных атомов
- •1.3.6.Связь периодического закона со строением атома
- •1.3.7.Физико-химические характеристики атома
- •. Химическая связь
- •. Основные характеристики химической связи. Классификация моделей описания химической связи
- •2.1.1.Основные параметры химической связи
- •2.1.2.Типы химической связи
- •2.2. Ковалентная химическая связь
- •2.2.1. Метод валентных связей (вс)
- •Пример. Энергия и длина связи в молекуле водорода, определенные экспериментально и рассчитанные с учетом различных факторов:
- •2.2.2.Кратные связи.- и-связи
- •Пример. Характеристики химических связей различной кратности:
- •2.2.3. Геометрия простейших молекул. Гибридизация ао
- •Примеры различных случаев гибридизации.
- •2.2.4. Донорно-акцепторный механизм образования ковалентной связи
- •2.2.5.Метод молекулярных орбиталей (мо)
- •Пример 1. Распределение валентных электронов по мо молекул и молекулярных ионов элементов первого периода.
- •2.3. Полярность связи. Дипольный момент молекулы
- •Пример.
- •. Химическая связь в твердых веществах и жидкостях
- •. Агрегатные состояния
- •Температуры (с), энтальпия (н0, кДж/моль) и энтропии (s0, Дж/мольк) фазовых переходов некоторых веществ при атмосферном давлении
- •.Межмолекулярное взаимодействие
- •3.2.1.Межмолекулярные взаимодействия (силы Ван-дер-Ваальса)
- •Относительный вклад каждой составляющей в энергию межмолекулярного взаимодействия для различных молекул
- •3.2.2.Водородная связь
- •Примеры.
- •.Химическая связь в твердом теле
- •3.3.1.Основные понятия о строении кристаллов
- •3.3.2.Молекулярные кристаллы
- •3.3.3.Ковалентные (атомные) кристаллы
- •3.3.4.Ионные кристаллы. Ионный тип химической связи
- •Энергия кристаллической решетки, рассчитанная по уравнению Борна, из термодинамики и измеренная экспериментально
- •3.3.5.Металлические кристаллы. Металлическая химическая связь
- •3.3.6.Зонная модель кристаллического тела
- •3.3.7.Металлы, полупроводники и диэлектрики
- •3.3.8.Кристаллические материалы
- •Собственные дефекты:
- •3.3.9.Аморфныетвердые тела
- •.Химическая связь в жидкостях
- •3.4.1.Жидкое состояние вещества
- •3.4.2.Жидкие кристаллы
- •Библиографический список
- •Основы общей химии
- •Часть 1. Строение вещества
- •190005, С-Петербург, 1-я Красноармейская ул., д.1
Пример. Характеристики химических связей различной кратности:
|
Связь |
Кратность |
Энергия, кДж/моль |
Длина, Ǻ |
|
CC |
Простая |
342 |
1,54 |
|
C=C |
Двойная |
600 |
1,34 |
|
CC |
Тройная |
826 |
1,20 |
|
FF |
Простая |
155 |
1,42 |
|
O=O |
Двойная |
494 |
1,21 |
|
NN |
Тройная |
942 |
1,10 |
|
Cl-Cl |
Простая |
239 |
1,99 |
|
Br-Br |
Простая |
190 |
2,28 |
2.2.3. Геометрия простейших молекул. Гибридизация ао
Вследствие того, что общая электронная пара локализована в области перекрывания атомных орбиталей, взаимное расположение атомов в молекуле будет определяться пространственной ориентацией валентных орбиталей.
Рассмотрим, например, пространственное строение молекул, образованных двумя атомами водорода и атомом халькогена (H2O, H2S, H2Se). В атомах водорода валентным является s-электрон (H 1s1), а в атомах халькогенов два неспаренных p-электрона (O, S, Se - ns2npx2py1pz1). Атом халькогена в этих молекулах образует две -связи с атомами водорода в результате перекрывания py- и pz-орбиталей с s-орбиталями. py- и pz-орбитали располагаются относительно друг друга под углом 90о, поэтому угол связи (валентный угол) должен быть равен этой величине (рис.2.9).
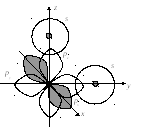
Рис. 2.18. Схема перекрывания атомных орбиталей в молекуле халькогенводорода
В то же время величина валентного угла зависит также от электростатического взаимодействия зарядов, возникающих на атомах молекулы в результате поляризации связи. На атомах водорода возникает эффективный положительный заряд +, величина которого прямо пропорциональна электроотрицательности халькогенов. Электростатическое взаимодействие атомов водорода приводит к увеличению угла связи, причем тем больше, чем больше +. Следовательно, максимальное отклонение валентного угла от 90о должно быть в молекуле H2O, а минимальное – в молекуле H2Se. Экспериментально полученные величины валентных углов в этих молекулах и электроотрицательности халькогенов представлены ниже:
|
|
халькогена (по Полингу) |
Валентный угол |
|
H2O................................... |
3,5 |
104,5о |
|
H2S................................... |
2,6 |
92,2о |
|
H2Se.................................. |
2,4 |
91,0о |
В ряде случаев описание химической связи в молекулах с использованием «обычных» атомных орбиталей вступало в противоречие с экспериментальными данными. Например, в молекуле BeH2 атом бериллия на внешнем уровне имеет два спаренных s-электрона (2s2). Для образования связи с двумя атомами водорода атом бериллия должен иметь два неспаренных электрона. Это возможно при переходе одного электрона на p-орбиталь (возбужденное состояние – 2s12px1). В этом случае в молекуле BeH2 связи между атомами бериллия и водорода должны быть разными (s-s и s-p). Эксперимент показывает, что в химическом плане оба атома водорода равноценны, то есть химические связи между атомами водорода и бериллия одинаковы.
Такого рода противоречия были разрешены с развитием Полингом (Pauling) и Слэтером (Slater) теории гибридизации атомных орбиталей. Было показано, что если в образовании атомом химической связи принимают участие орбитали различной симметрии, не сильно различающиеся по энергии, то при описании химической связи они могут быть заменены таким же числом равноценных гибридных орбиталей.
При построении гибридных волновых функций выполняются следующие правила:
1. Волновая
функция, описывающая гибридную орбиталь,
представляет собой сумму исходных
атомных волновых функций с учетом их
вклада:![]() ,
гдесi
–
нормирующие множители, учитывающие
вклад каждой атомной орбитали.
,
гдесi
–
нормирующие множители, учитывающие
вклад каждой атомной орбитали.
Г ибридные
орбитали имеют определенную пространственную
конфигурацию, отличную от атомных (рис.
2.10).
ибридные
орбитали имеют определенную пространственную
конфигурацию, отличную от атомных (рис.
2.10).
Рис. 2.19. Схема образования sp- и pd-гибридных орбиталей
2. Энергия всех гибридных орбиталей одинакова. Их суммарная энергия меньше, чем суммарная энергия исходных атомных орбиталей. При гибридизации энергия системы понижается.
3. Число гибридных орбиталей равно числу исходных атомных орбиталей. Максимальное число гибридных орбиталей с участием s, p и d-электронов не может быть больше шести.
4. При образовании химической связи возможны случаи, когда гибридизуются не все валентные электроны. Как правило, гибридные орбитали образуют -связи и в основном определяют пространственную ориентацию соседних атомов (геометрию молекулы), а негибридизовавшиеся орбитали могут образовывать дополнительные связи (например, -связи).
