
- •Перекрывание по - типу
- •Перекрывание по - типу
- •Кратные связи
- •Примеры
- •2.5 Геометрия простейших молекул (ВС). Гибридизация АО
- •Молекулы H2O, H2S, H2Se
- •Гибридизация
- •Гибридные орбитали
- •Примеры
- •Пример
- •Пример dsp2-гибридизация
- •2.6 Донорно-акцепторный механизм образования ковалентной связи
- •2.7Метод молекулярных орбиталей (МО)
- •Молекулярные орбитали молекулы водорода
- •Энергетическая диаграмма молекулы водорода
- •Метод МО
- •Энергетическая диаграмма молекулы NO
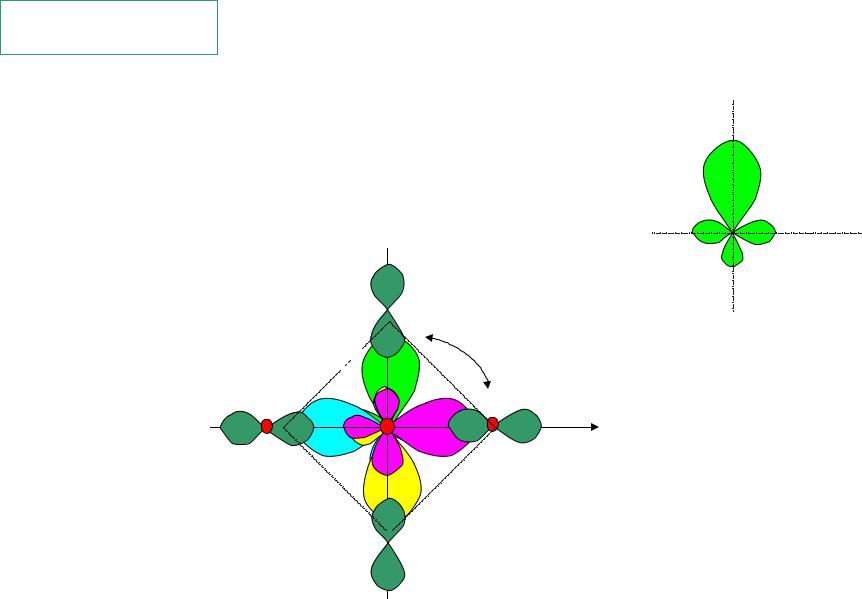
Пример dsp2-гибридизация
молекулярный ион [CuCl4]-2
плоский квадрат
dsp2 c1 s c2 px c3 py c4 dx2 y2
 y
y
Cl 
Cu









90
Cl |
Cl |
x |
 Cl
Cl
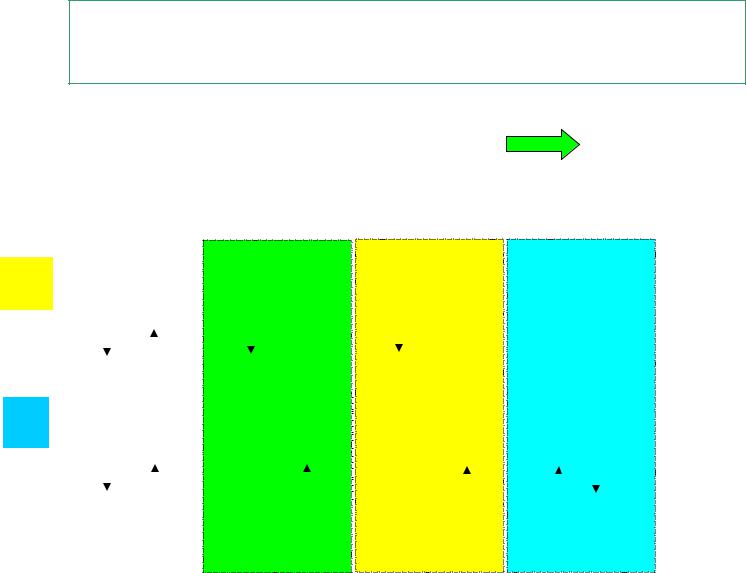
2.6 Донорно-акцепторный механизм образования ковалентной связи
Молекула СО |
Есв =1071кДж/моль |
связь тройная |
C |
|
2s2 |
|
2px1 |
2py1 |
2pz0 |
акцептор |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
2s2 |
2px1 |
2py1 |
2pz2 |
донор |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
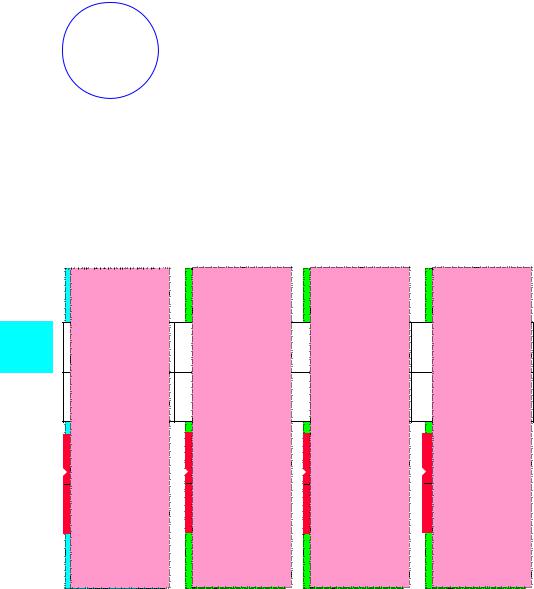
Ион [NH ]+ |
NH + H+ [NH ]+ |
|
4 |
3 |
4 |
четыре равноценных атома водорода
тетраэдрическая конфигурация sp3-гибридные орбитали
N 2s22px12py12pz1 |
Н 1s1 |
Н+ 1s0 |
N |
sp3 |
sp3 |
sp3 |
sp3 |
|
1s0 |
|
1s |
|
1 |
|
1s |
|
1 |
|
1s |
|
1 |
|
|
|
|
|
|
|||||||
|
|
|
|
|
||||||||
H+ |
|
H0 |
|
H0 |
|
H0 |
||||||
|
|
|
|
|
|
|||||||

2.7Метод молекулярных орбиталей (МО)
1.Каждый электрон в молекуле движется в результирующем поле всех ядер и остальных электронов. Молекула рассматривается как единая частица.
2.Волновые функции описывают молекулярные орбитали. Линейная комбинация АО. МО многоцентровые.
3.Совокупность молекулярных орбиталей называется
электронной конфигурацией молекулы.
Заполнение электронами молекулярных орбиталей осуществляется согласно
•принципа минимума энергии,
•принципа Паули,
•правила Хунда.

Молекулярные орбитали молекулы водорода
Ψ1 c1 (ΨA ΨB ) |
Ψ2 с2 (ΨА ΨВ ), |
|
|
|
Молекулярные орбитали |
Атомные орбитали |
2 (– разрыхляющая) |
|
А(1s) |
В(1s) |
|
1(– связывающая)
А В
АВ
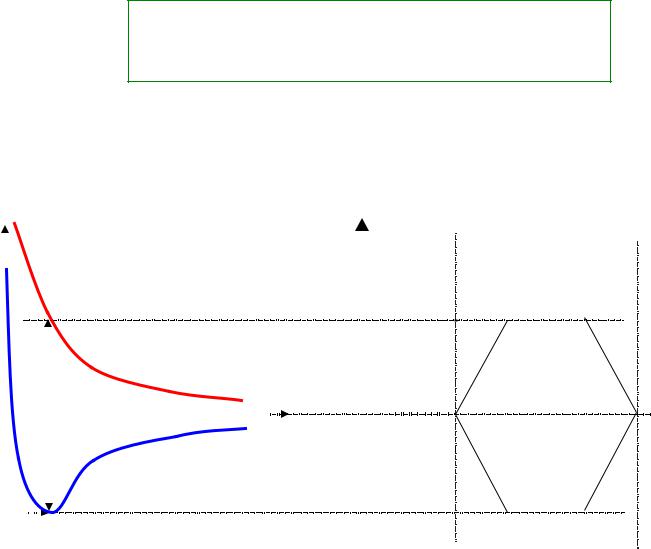
Энергетическая диаграмма молекулы водорода
Е(r) |
|
|
|
|
Е(rсв) |
АО |
МО |
АО |
||||
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
р |
|
||
|
|
|
|
Е(r) – разрыхляющая |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
r |
|
1s |
|
|
|
1s |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
Е(r) – связывающая |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
rcв |
|
|
|
|||||||
|
|
|
|
|
|
|
|
св |
|
|||
|
|
|
|
|
|
|
|
|
||||
Метод МО
1. Выбираются АО, принимающие участие в образовании химической связи
(валентные орбитали).
Для s- и p-элементов валентными орбиталями являются ns- и np-электроны.
2. Взаимодействующие АО должны иметь одинаковую симметрию относительно линии связи, при этом число образующихся МО равно числу АО.
ns-атомные орбитали образуют две -молекулярные оритали. np-орбитали образуются две - и четыре -молекулярные орбитали.
3. Точное значение энергий МО необходимо рассчитывать, можно пользоваться известными качественными схемами энергетических диаграмм молекул определенного типа.
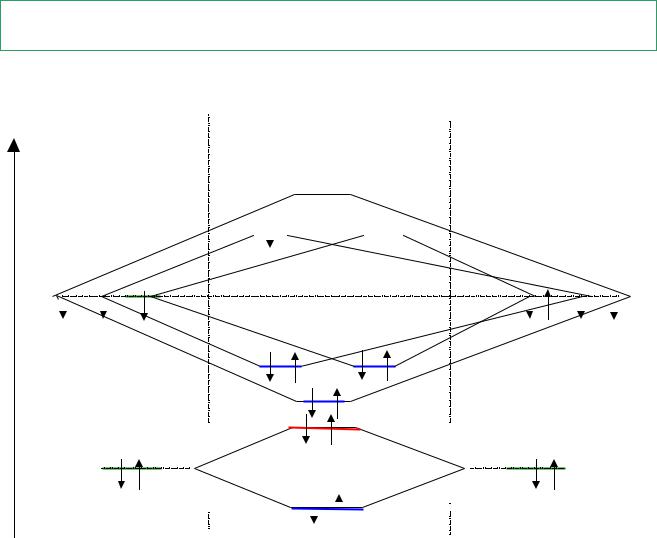
Энергетическая диаграмма молекулы NO
Е(r ) АО |
|
|
|
МО |
|
|
|
|
|
АО |
||||||||||||||
св |
|
|
|
N |
|
|
|
NO |
|
|
|
|
|
|
O |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
р(px) |
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
px py pz |
|
|
|
|
|
|
|
|
|
pz py px |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
р(py) |
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
(p ) |
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
р |
|
z |
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
св(py) св(pz)
2s |
св(px) |
р(s) |
2s |
|
|
|
|
|
св(s) |
КС 8 |
3 2.5 |
|
|
|
|
|||
|
|
|
||||
|
|
|
|
|||
|
|
|||||
|
NO [ св(s)]2 [ (s) р]2[ св(px)]2[ св(py)]2[ св(pz)]2[ р(py)]1 |
|||||
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
парамагнетик |
|
|
|
||
