
- •Биоорганическая химия
- •Изомерия органических соединений
- •Классификация изомерии
- •Структурная изомерия
- •Пространственная изомерия (стереоизомерия)
- •Конфигурационные изомеры.
- •Лекция 2 Сопряженные системы
- •Классификация органических реакций
- •Лекция 3 Кислотность и основность
- •Кислоты Бренстеда
- •Лекция 4 Спирты
- •Одноатомные спирты Номенклатура:
- •Физические св-ва
- •Карбокатион
- •Лекция 5 Фенолы
- •Строение молекулы амина
- •Замещенный имин
- •Лекция 8
- •Лекция 9 Карбоновые кислоты
- •Мочевина
- •Лабораторно-семинарское занятие № 4 Тема: «Монофункциональные соединения» Свойства спиртов альдегидов, кетонов и фенолов.
- •Лекция 10 Оксо – окси - фенолокислоты
- •Лекция 11 Аминофенолы, аминоспирты, липиды.
- •Классификация
- •Фосфатидная кислота. Фосфатиды
- •Лекция 12. Углеводы (ув)
- •Лекция Аминокислоты (ак)
- •Лекция 14 Белки
- •Лекция 15 Гетероциклические соединения
- •Лекция 16 Нуклеиновые к-ты
- •Лабораторно-семинарское занятие № 5 Тема: «Гетерофункциональные соединения» Свойства спиртов альдегидов, кетонов и фенолов.
- •Примерные тесты по органической химии
- •Билет № 5
- •Билет № 7
- •Билет № 10
- •Билет № 15
- •Билет № 19
- •Билет № 20
- •Раздел III Биоорганическая химия. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 3
Строение молекулы амина

Нуклеофильный и оснóвный центры
В связи с меньшей полярностью связи С – N (0,45 D) по сравнению с полярностью N – Н (1,3 D) для аминов не характерны р-ции замещения гр. NН2 – и кислотные св-ва.
Важнейшее св-во аминов связано с наличием свободной электронной пары у атома N и его способностью присоединять «+» частицы. С этим связано проявление аминами свойств оснований, т.е. присоединять Н+ от воды и кислот, а также вступать в р-ции алкилирования, ацилирования, выполняя при этом роль Nu.
Химические свойства
I. Оснóвные св-ва
Амины более сильные основания, чем NH3. Это объясняется + I эффектом радикалов. Чем больше электронная плотность на атоме N, тем больше основность. Вторичные амины более сильные основания, чем первичные. Основность третичных аминов уменьшается, что объясняется экранирующим влиянием атома N тремя алкильными группами.
Поскольку ЭО атома N меньше ЭО атома О, амины образуют менее прочные ассоциаты, чем соответствующие спирты и имеют более низкие температуры кипения. Температура кипения этанола 78 оС, а этиламина – 17 оС.
При растворении в воде к аминам присоединяется Н+ от молекулы НОН, поэтому растворы аминов имеют щелочную р-цию:
С2Н5![]() H2
+ HOH
[С2Н5
H2
+ HOH
[С2Н5![]() H3]OH
H3]OH
Гидроксидэтиламмония
При действии к-т образуются соли:
С2Н5![]() H2
+ HС1
[С2Н5
H2
+ HС1
[С2Н5![]() H3]Сl
H3]Сl
Хлоридэтиламмония
Щелочи разлагают соли аминов и выделяют свободные амины:
[С2Н5![]() H3]Сl
+ NaOH
NaCl
+ С2Н5NH2
+ H2O
H3]Сl
+ NaOH
NaCl
+ С2Н5NH2
+ H2O
Особенно сильные оснóвные св-ва у чертвертичных аммониевых оснований, которые по силе соответствуют щелочам:

Оснóвные св-ва ароматических аминов ослаблены за счет р,-сопряжения NH2 – группы с бензольным кольцом. Поэтому анилин образует соли только с сильными минеральными к-тами. Водный р-р анилина не изменяет окраску индикаторов.
II. Р-ции алкилирования и ацилирования
В этом случае амины проявляют нуклеофильные св-ва за счет электронной пары атома азота.
Реакция алкилирования (замещение атомов водорода в гр. NH2 на углеводородный радикал, в результате чего образуется вторичный амин):
С2Н5NH2 + СН3CI → С2Н5NH-CH3 + HCI
метилэтиламин
Реакция ацилирования (замещение атомов водорода в гр. NH2 на ацильный радикал):
С2Н5NH2 + СН3 C-CI → С2Н5NH-C-CH3 + HCI
║ ║
O O
Подобным образом алкилируется и ацилируется С6Н5NH2.
С6Н5NH2 + СН3CI → С6Н5NH-CH3 + HCI (реакция алкилирования)
С6Н5NH2 + СН3 COCI → С2Н5NH-C-CH3 + HCI (реакция ацилирования)
║
О
I
(основание
Шиффа)Замещенный имин
R – NH2
+ O =
![]() – R
– R![]() R – N =
R – N =![]() – R
– R
IV. Качественные р-ции на амины (р-ция с HNO2)
С2Н5 – NH2 + O = N – OH
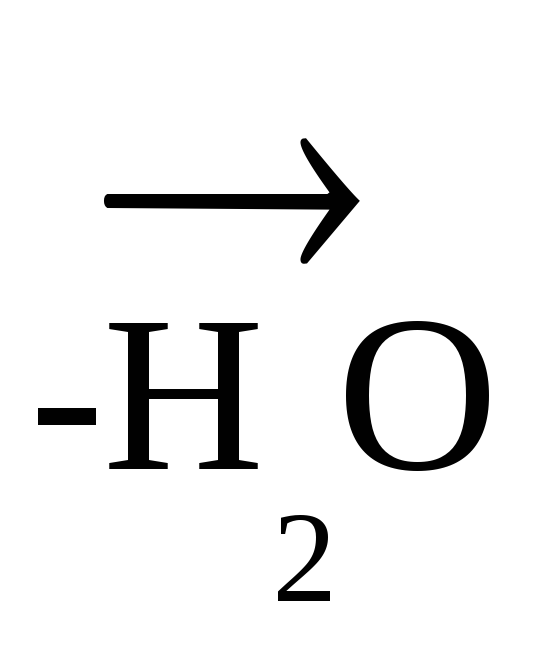 [С2Н5
– N=
N
– OH]
[С2Н5
– N=
N
– OH]
 С2Н5OH
С2Н5OH + HONO
+ HONO

 -NO
-NO
Желтый Нитрозоамины
Нитрозоамины являются канцерогенными веществами. Нитраты в организме восстанавливаются до нитритов.
R3N: + НNO2 [R3NH]+NO2
Соль
При действии HNO2 на соли анилина образуется не фенол, а соли диазония (широко используемые в химии красителей), которые при нагревании выделяют азот N2 с образованием фенола:
[С6Н5![]() H3]Cl
+ HONO
[С6Н5
H3]Cl
+ HONO
[С6Н5![]() N]Cl
+ 2Н2О
N]Cl
+ 2Н2О
Соль диазония
[С6Н5![]() N]Cl
+ 2Н2О
N]Cl
+ 2Н2О
![]() N2
+ HCl
+ С6Н5OH
N2
+ HCl
+ С6Н5OH
Р-ции по радикалу

Сульфаниловая
к-та – важный продукт в синтезе
лекарственных веществ (сульфаниламидных
препаратов) и красителей. Наибольшую
активность имеют производные
сульфаниламидов, в которых атом Н в
группе – SO2NH2
замещен на гетероцикл. Например,
сульфадиметоксин:
Сульфаниламиды, являясь антиметаболитами n-аминобензойной к-ты (ПАБК), блокируют биосинтез фолиевой к-ты (витамин Вс), необходимой для нормального развития и размножения микроорганизмов. Сульфаниламиды имеют сходные геометрические параметры с ПАБК, что позволяет им встраиваться вместо последней в синтез фолиевой к-ты.
Л и т е р а т у р а
Тюкавкина С. 154-180, 229.
Контрольные вопросы к теме: «Амины»
1. Какие вещества называются аминами.
2. Классификация аминов.
3. Изомерия аминов. Чем она обусловлена?
4. Какие из алифатических аминов проявляют более выраженные основные свойства.
5. Докажите, что анилин является сопряженной системой.
6. Какие эффекты проявляет группа NH2 в анилине?
Упражнения:
1. Напишите все изомеры формулы С4H11N. Назовите их по м.н.
2. Напишите реакции взаимодействия этиламина с HNO3, CH3Cl.
3. Напишите реакции взаимодействия анилина Br2, HO-NO2, HO-SO3H
4. Какое из соединений: метиламин или анилин проявляет более выраженные основные свойства. Напишите соответствующие реакции.
5. Напишите качественную реакцию на первичные, вторичные и третичные амины.
Напишите уравнение реакции взаимодействия анилина с ангидридом уксусной кислоты. Укажите механизм реакции.
Лекция 7
Тиолы
Их можно рассматривать как производные Н2S, где один или оба атома Н замещены на радикал: R – SH
Тиолы имеют неприятный запах. Пропантиол содержится в луке.
Химические св-ва
Тиолы диссоциируют:
RS – H RS + H+, рК 11
Тиолы взаимодействуют с щелочами и солями тяжелых Ме:
СН3S – H + NaOH СН3S – Na + H2O
Метилтиолят натрия или меркаптид натрия
С солями ртути (II) образуются нерастворимые соли. На этом основано применение тиолов при отравлении солями Нg, As, Bi, Cr, Pb, Zn, Cd и др.
![]()

 + НgС12
+ НgС12
![]() Нg
+ 2НС1
Нg
+ 2НС1
Лекарственный препарат БАЛ (британский антилюизит) – дитиоглицерин, или 2,3-димеркаптопропанол.
Унитиол – 2,3-димеркаптопропансульфонат натрия – в виде 5%-ного раствора с рН 3-5 широко применяется в медицине при отравлении солями тяжелых Ме. Группы – SH вступают в р-цию с ядами в крови тканях, образуя нетоксичные комплексы и выводятся с мочой. Унитиол < токсичен, чем БАЛ.
Люизит
![]()


Подобно спиртам тиолы образуют простые и сложные эфиры, однако, как правило, не с к-той, а с ее производными:


4. Окисление тиолов отличается от окисления спиртов. Тиолы легко окисляются и в мягких условиях образуют дисульфиды:
2R
– SH
![]() R–S–S–R
R–S–S–R
Л и т е р а т у р а
Тюкавкина С. 159-162.
Контрольные вопросы к теме: «Тиолы»
Какие соединения называются тиолами?
Изомерия тиолов. Чем она обусловлена?
Почему тиолы проявляют более сильные кислотные свойства, чем спирты?
Какой эффект проявляет группа SH в молекуле пропантиола? Она является ЭД или ЭА?
С точки зрения электронного строения молекулы пропантиола химические свойства тиолов.
Упражнения и ситуационные задачи.
Пропантиол содержится соке лука. Напишите реакии, характеризующие его свойства.
Унитиол – 2,3-димеркаптопропансульфонат натрия – в виде 5%-ного водного раствора применяется при отравлении солями тяжелых металлов (мышьяка, ртути хрома, висмута и др.). Напишите реакцию его образования.
Напишите реакцию образования простого и сложного эфира этантиола.
Напишите реакцию солеобразования этантиола с хлоридом ртути (II).
Напишите реакцию окисления тиолов.
