
- •Биоорганическая химия
- •Изомерия органических соединений
- •Классификация изомерии
- •Структурная изомерия
- •Пространственная изомерия (стереоизомерия)
- •Конфигурационные изомеры.
- •Лекция 2 Сопряженные системы
- •Классификация органических реакций
- •Лекция 3 Кислотность и основность
- •Кислоты Бренстеда
- •Лекция 4 Спирты
- •Одноатомные спирты Номенклатура:
- •Физические св-ва
- •Карбокатион
- •Лекция 5 Фенолы
- •Строение молекулы амина
- •Замещенный имин
- •Лекция 8
- •Лекция 9 Карбоновые кислоты
- •Мочевина
- •Лабораторно-семинарское занятие № 4 Тема: «Монофункциональные соединения» Свойства спиртов альдегидов, кетонов и фенолов.
- •Лекция 10 Оксо – окси - фенолокислоты
- •Лекция 11 Аминофенолы, аминоспирты, липиды.
- •Классификация
- •Фосфатидная кислота. Фосфатиды
- •Лекция 12. Углеводы (ув)
- •Лекция Аминокислоты (ак)
- •Лекция 14 Белки
- •Лекция 15 Гетероциклические соединения
- •Лекция 16 Нуклеиновые к-ты
- •Лабораторно-семинарское занятие № 5 Тема: «Гетерофункциональные соединения» Свойства спиртов альдегидов, кетонов и фенолов.
- •Примерные тесты по органической химии
- •Билет № 5
- •Билет № 7
- •Билет № 10
- •Билет № 15
- •Билет № 19
- •Билет № 20
- •Раздел III Биоорганическая химия. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 3
Лекция 4 Спирты
Это производные УВ, у которых один или несколько атомов Н замещены на –ОН группу.
Классификация:
I. По количеству групп ОН различают одноатомные, двухатомные и многоатомные спирты:
СН3СН2ОН
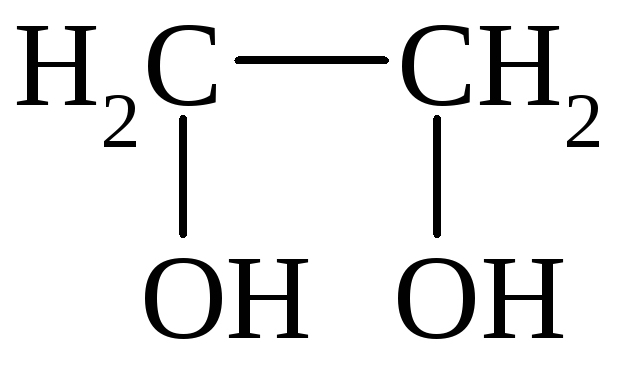
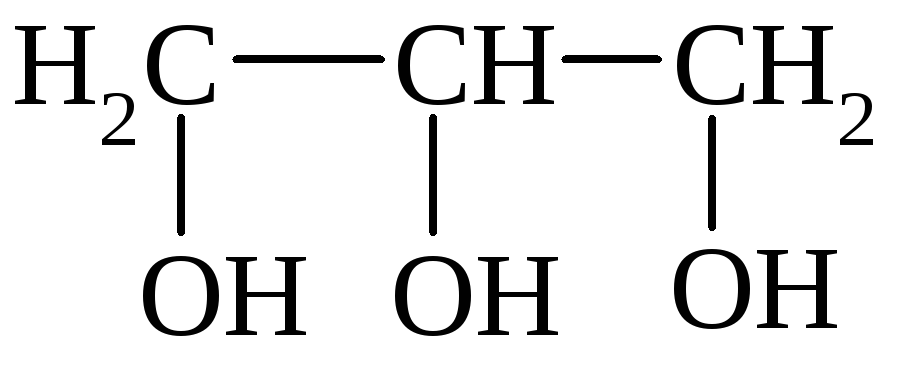
Этанол Этиленгликоль Глицерин
II. По характеру R различают: 1) предельные, 2) непредельные 3) циклические, 4) ароматические.
СН3-СН2-ОН 2) СН2 = СНСН2ОН
Этанол (предельный спирт) пропен-2-ол (непредельный спирт)
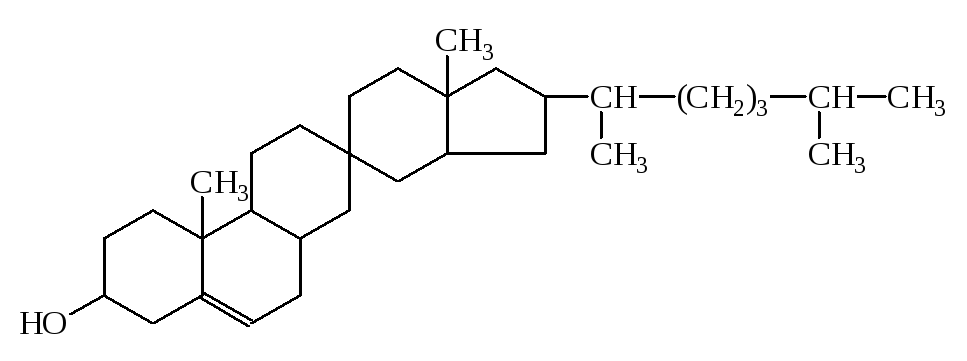
3) К непредельным циклическим спиртам относятся:ретинол (витаминА) и холестерин
 витамин
А
витамин
А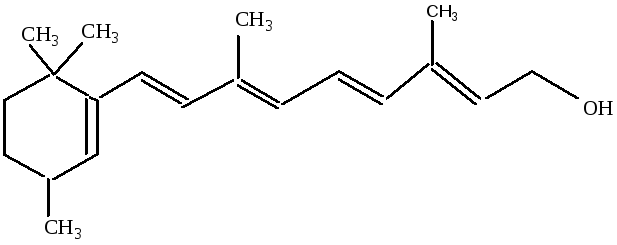
Холестерин
Одноатомные спирты Номенклатура:
Тривиальная, рациональная, МН (корень+окончание «ол»+арабская цифра).
Изомерия:
цепи, положения гр. –ОН, оптическая.
Строение молекулы спирта


 СН-кислотныйNu
центр
СН-кислотныйNu
центр
SN SЕ
'+ - +
.. ..
С
 Н3
СН2
О Н
Н3
СН2
О Н
Электрофильный Центр Кислотный
центр основности центр
Р-ции окисления и Е
Спирты – слабые кислоты.
Спирты – слабые основания. Присоединяют Н+ лишь от сильных кислот, но они более сильные Nu.
–I эффект гр. –ОН увеличивает подвижность Н у соседнего углеродного атома. Углерод приобретает + (электрофильный центр, SЕ) и становится центром нуклеофильной атаки (Nu). Связь С–О рвется более легко, чем Н–О, поэтому характерными для спиртов явл-ся р-ции SN. Они, как правило, идут в кислой среде, т.к. протонирование атома кислорода увеличивает +
атома углерода и облегчает разрыв связи. К этому типу относятся р-ции образования эфиров, галогенопроизводных.
Смещение элекронной плотности от Н в радикале приводит к появлению СН-кислотного центра. В этом случае идут р-ции окисления и элиминирования (Е).
Физические св-ва
Низшие спирты (С1–С12) – жидкости, высшие – твердые вещ-ва. Многие св-ва спиртов объясняются образованием водородной связи:
![]()
Химические св-ва
Кислотно-оснóвные свойства. Спирты – слабые амфотерные соединения.
Взаимодействие с натрием (кислотные свойства)
2С2H5–ОН + 2Nа 2 С2H5–ОNа + Н2
этилат натрия
Алкоголяты легко гидролизуются, что показывает – спирты более слабые кислоты, чем вода:
С2H5– ОNа + НОН С2H5–ОН + NаОН
Взаимодействие с сильной кислотой НС1 (основные свойства). Оснóвный центр в спиртах – гетероатом О:
С
Осн-ие К-та![]() Н
+
Н
+
![]() Сl
[СН3СН2
Сl
[СН3СН2![]() Н]Сl
Н]Сl
Этилоксоний хлорид
II. Реакции SN по гр. –ОН
Гр. ОН является плохоуходящей группой (связь мало полярна), поэтому большинство р-ций проводят в кислой среде. Механизм р-ции:
С
Карбокатион
 Н3СН2ОН
+ Н+
СН3СН2
Н3СН2ОН
+ Н+
СН3СН2![]() Н
СН3СН2+
+ Н2О
Н
СН3СН2+
+ Н2О
Если р-ция идет с галогеноводородами, то присоединяться будет галогенид-ион: СН3СН2 - ОН + НСl СН3СН2Сl + Н2О
Это р-ция алкилирования (введение алкила R в молекулу).
Заместить –ОН гр. на галоген можно при действии РСl3, РСl5 и SОСl2, например:
С2Н5ОН + РСl5 → С2Н5Сl + HCl + POCl3
По такому механизму легче реагируют третичные спирты.
III. Р-цией SЕ по отношению к молекуле спирта является р-ция образования сложных эфиров с органическими и минеральными к-тами:
Взаимодействие с уксусной кислотой.
С 2H5
– О Н + Н О –
2H5
– О Н + Н О –

![]() СН3
– О –
СН3
– О – + Н2О
+ Н2О
Сложный эфир
В
С2H5 – О Н + Н О – NО2
 С2H5
– О –NО2
+ Н2О
С2H5
– О –NО2
+ Н2О заимодействие
с азотной кислотой:
заимодействие
с азотной кислотой:
IV. Р-ции Е (отщепления, или элиминирования)
Эти р-ции конкурируют с реакциями SN.
С![]() Н3СН2ОН
+ Н+
Н3СН2ОН
+ Н+
 СН3СН2
СН3СН2![]() Н
Н
![]() СН3СН2+
СН3СН2+
При избытке Н2SО4 и более высокой температуре, чем в случае р-ции образования простых эфиров, идет регенерация катализатора и образуется алкен:
СН3СН2+ + НSО4 СН2 = СН2 + Н2SО4
Легче идет р-ция SE для третичных спиртов, труднее для вторичных и первичных, т.к. в последних случаях образуется менее стабильные катионы. В данных р-циях выполняется правило А. Зайцева: «При дегидратации спиртов атом Н отщепляется от соседнего атома С с меньшим содержанием атомов Н».

 СН3СН
= СН СН3
СН3СН
= СН СН3
Бутанол-2
В организме гр. –ОН превращается в легкоуходящую путем образования эфиров с Н3РО4:
С Н3СН2ОН
+ НО–РО3Н2
Н3СН2ОН
+ НО–РО3Н2
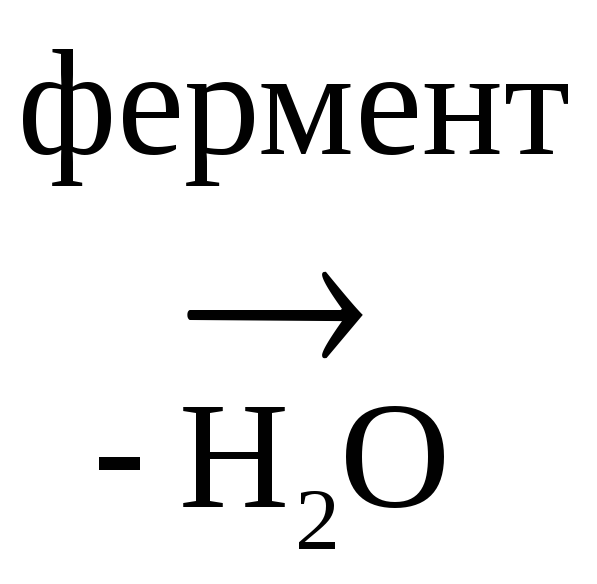 СН3СН2ОРО3Н2
СН3СН2ОРО3Н2
V. Р-ции окисления
1) Первичные и вторичные спирты окисляются СuО, растворами КМnО4, К2Сr2О7 при нагревании с образованием соответствующих карбонилсодержащих соединений:
С
Пропионовый альдегид
альдегид
Пропанол-1

 Н3СН2
Н3СН2![]() ОН
+ О
ОН
+ О![]() СН3CH2
СН3CH2![]() ОН
ОН
![]() СН3СН2
СН3СН2![]() Н
Н
С
Пропанол-2

 Н3
Н3
![]()
СН3
+ О
СН3
+ О![]() СН3
СН3![]()
СН3
СН3![]() СН3
СН3
![]() СН3
СН3
Ацетон (кетон)
2) Третичные спирты окисляются с трудом.
К реакциям окисления относятся и р-ции дегидрирования:
СН3
![]()
ОН
ОН
![]() СН3
СН3
![]() =
О + Н2
=
О + Н2
VI. По
радикалу (R)
протекают реакции, характерные для
соответствующих углеводородов (УВ). В
случае предельных – SR,
непредельных – АN,
ароматических – SЕ:СН3СН2ОН
+ 3Вr2
![]() СВr3СН2ОН
+ 3НВr
СВr3СН2ОН
+ 3НВr
Этанол Нарколан
СН2
=
СНСН2ОН
+ Вr2
![]() СН2
Вr–СНВr–СН2ОН
СН2
Вr–СНВr–СН2ОН
Аллиловый спирт 2,3- Дибромпропанол
Бензиловый спирт n-Нитрофенилметанол
Многоатомные спирты
Для этих спиртов характерны все р-ции одноатомных спиртов, однако имеется ряд особенностей.
1) За счет – гр. –ОН многоатомные спирты обладают более выраженными кислотными свойствами по сравнению с одноатомными спиртами т.к. она способствует делокализации электронной плотности. Они образуют алкоголяты не только с щелочными Ме, но и с щелочами:

Глицерин
Эта реакция отличает одноатомные спирты от многоатомных.
Качественной р-цией на двухатомные и многоатомные спирты (диольный фрагмент) является р-ция с Сu(ОН)2 в щелочной среде:

Глицерин Гликолят меди (II)
Синее окрашивание
Р-ции многоатомных спиртов могут протекать по одной или всем группам –ОН. Они образуют алкоголяты, простые и сложные эфиры, дегидратируются, окисляются.
-
2)

Этиленгликоль Диоксан
(Циклический диэфир)
-
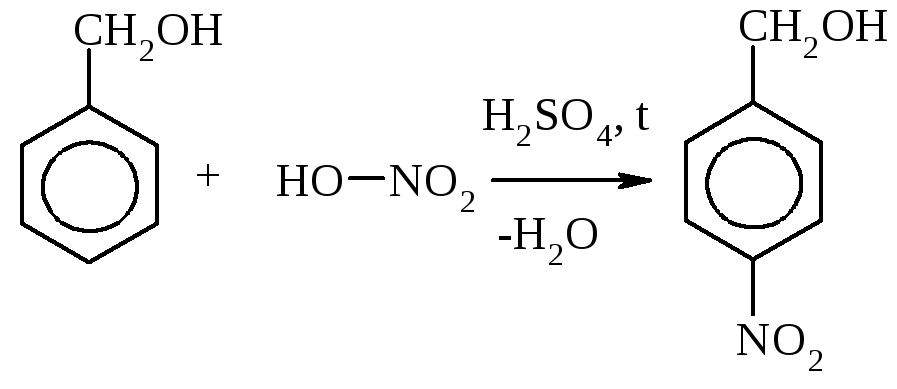
3)
Нитроглицерин – бесцветная маслянистая жидкость. В виде разбавленных спиртовых растворов (1%) применяется при стенокардии, т.к. оказывает сосудорасширяющее действие. Нитроглицерин – сильное взрывчатое веще
ство, способное взрываться от удара или при нагревании. При этом в малом объеме, который занимает жидкое вещество, мгновенно образуется очень большой объем газов, что и вызывает сильную взрывную волну. Нитроглицерин входит в состав динамита, пороха.

Представители пентитов и гекситов – ксилит и сорбит – соответственно, пяти- и шестиатомные спирты с открытой цепью. Накопление –ОН групп ведет к появлению сладкого вкуса. Ксилит и сорбит – заменители сахара для больных диабетом.
Химические свойства непредельных спиртов аналогичны предельным, однако за счет двойных или тройных связей они вступают в р-ции присоединения, полимеризации, окисления.
Л и т е р а т у р а:
1.Тюкавкина С. 153-158, 242-246.
Контрольные вопросы к теме: «Спирты»
Какие соединения называются спиртами?
Классификация спиртов.
Чем обусловлена изомерия спиртов? Приведите примеры.
Физические свойства спиртов.
Электронное строение одноатомных спиртов.
Химические свойства спиртов: а) кислотно-основные свойства, б) реакции SЕ,
в) реакци SN, г) реакции дегидратации и дегидрирования.
Упражнения и ситуационные задачи.
Изобразите строение молекулы этилового спирта. Укажите четыре реакционных центра.
Напишите реакцию, доказывающую кислотные свойства пропанола.
Напишите реакцию этерификации бутанола-1 с уксусной кислотой.
Сравните кислотные свойства этанола и этадиола и напишите соответствующие реакции.
Напишите качественную реакцию на многоатомные спирты.
В присутствии серной кислоты и при нагревании этиловый спирт претерпевает внутримолекулярную дегидратацию. Укажите механизм и напишите реакцию.
Напишите реакцию окисления пропанола-2.
Напишите реакцию взаимодействия бутанола с хлороводородом. Укажите механизм реакции и назовите продукты.
Напишите реакцию образования простого эфира из пропанола-1 и пропанола-2.
Нитроглицерин в спиртовом растворе применяется при стенокардии в качестве сосудорасширяющего средства, напишите реакцию его образования.
