
- •Биоорганическая химия
- •Изомерия органических соединений
- •Классификация изомерии
- •Структурная изомерия
- •Пространственная изомерия (стереоизомерия)
- •Конфигурационные изомеры.
- •Лекция 2 Сопряженные системы
- •Классификация органических реакций
- •Лекция 3 Кислотность и основность
- •Кислоты Бренстеда
- •Лекция 4 Спирты
- •Одноатомные спирты Номенклатура:
- •Физические св-ва
- •Карбокатион
- •Лекция 5 Фенолы
- •Строение молекулы амина
- •Замещенный имин
- •Лекция 8
- •Лекция 9 Карбоновые кислоты
- •Мочевина
- •Лабораторно-семинарское занятие № 4 Тема: «Монофункциональные соединения» Свойства спиртов альдегидов, кетонов и фенолов.
- •Лекция 10 Оксо – окси - фенолокислоты
- •Лекция 11 Аминофенолы, аминоспирты, липиды.
- •Классификация
- •Фосфатидная кислота. Фосфатиды
- •Лекция 12. Углеводы (ув)
- •Лекция Аминокислоты (ак)
- •Лекция 14 Белки
- •Лекция 15 Гетероциклические соединения
- •Лекция 16 Нуклеиновые к-ты
- •Лабораторно-семинарское занятие № 5 Тема: «Гетерофункциональные соединения» Свойства спиртов альдегидов, кетонов и фенолов.
- •Примерные тесты по органической химии
- •Билет № 5
- •Билет № 7
- •Билет № 10
- •Билет № 15
- •Билет № 19
- •Билет № 20
- •Раздел III Биоорганическая химия. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 3
Лекция 3 Кислотность и основность
Для характеристики кислотности и основности органических соединений применяют теорию Бренстеда. Основные положения этой теории:
Кислота – это частица, отдающая протон (донор Н+); основание – это частица, принимающая протон (акцептор Н+).
Кислотность всегда характеризуется в присутствии оснований и наоборот.Примеры:
А – Н + : В А– + В – Н+
К-та Осн-ие Сопряженное Сопряженная
осн-ие к-та
СН3СООН + НОН ↔ СН3СОО– + Н3О+
К-та Осн-ие Сопряженное Сопряженная
осн-ие к-та
Кислоты Бренстеда
К-ты Бренстеда делятся на 4 вида в зависимости от кислотного центра:
 SН
к-ты (тиолы),
SН
к-ты (тиолы),
ОН к-ты (спирты, фенолы, карбоновые к-ты),
NН к-ты (амины, амиды),
СН к-ты (УВ).
В этом ряду сверху вниз кислотность уменьшается.
Сила к-ты определяется стабильностью образующегося аниона. Чем стабильнее анион, тем сильнее к-та. Стабильность аниона зависит от делокализации (распределения) «» заряда по всей частице (аниону). Чем больше делокализован «» заряд, тем стабильнее анион и сильнее к-та.
Делокализация заряда зависит:
от электроотрицательности (ЭО) гетероатома. Чем больше ЭО гетероатома, тем сильнее соответствующая к-та.
Например: R – ОН и R – NН2
Спирты более сильные к-ты, чем амины, т.к. ЭО (О) > ЭО (N).
б) от поляризуемости гетероатома. Чем больше поляризуемость гетероатома, тем сильнее соответствующая к-та.
Например: R – SН и R – ОН
Тиолы более сильные к-ты, чем спирты, т.к. атом S более поляризован, чем атом О.
в) от характера заместителя R (длины его, наличие сопряженной системы, делокализации электронной плотности).
Например: СН3 – ОН, СН3 – СН2 – ОН, СН3 – СН2 – СН2 – ОН
 Кислотность
<, т.к. увеличивается длина радикала
Кислотность
<, т.к. увеличивается длина радикала
При одинаковом кислотном центре сила спиртов, фенолов и карбоновых к-т не одинакова. Например,
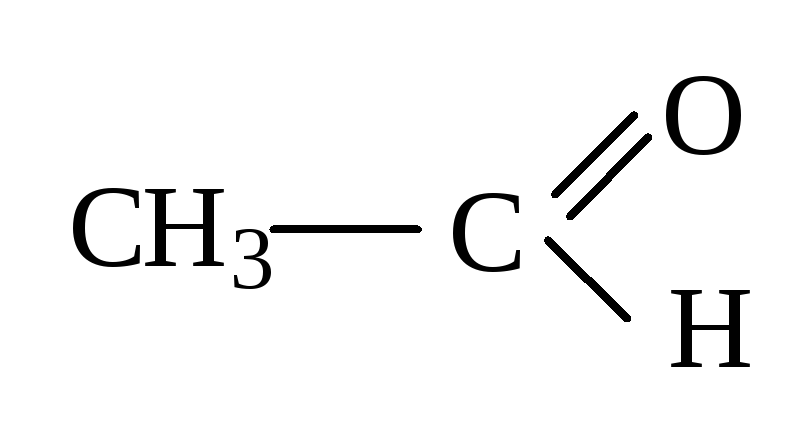
СН3 – ОН, С6Н5 – ОН,

Сила к-ты увеличивается
Фенолы являются более сильными кислотами, чем спирты за счет р, π-сопряжения группы ОН, которая оказывает +М эффект. Связь О→Н сильнее поляризуется в фенолах. Фенолы могут взаимодействовать даже с солями, например с FeCl3 – эта реакция является качественной на фенолы. Карбоновые кислоты по сравнению со спиртами, содержащими одинаковый радикал, являются более сильными кислотами, т.к., связь О→Н значительно поляризована за счет –М эффекта группы > С=О
г) от характера растворителя.
Если растворитель является хорошим акцептором протонов Н+, то сила к-ты увеличивается и наоборот.
Основания Бренстеда
Они делятся на:
а) -основания (соединения с кратными связями);
б)
n-основания
(аммониевые, содержащие атом
![]() ,
,
в)
оксониевые, содержащие атом
![]() ,
,
г)
сульфониевые, содержащие атом
![]() )
)
Сила основания определяется стабильностью образующегося катиона. Чем стабильнее катион, тем сильнее основание..
Стабильность катиона зависит от тех же факторов, что и стабильность аниона, но с обратным действием. Все факторы, усиливающие кислотность, уменьшают основность.
Самыми сильными основаниями являются амины, т.к. атом азота имеет меньшую ЭО по сравнению с О. При этом вторичные амины более сильные основания, чем первичные, третичные амины слабее вторичных за счет стерического фактора, затрудняющего доступ протона к N.


Ароматические амины более слабые основания, чем алифатические, что объясняется +М группы –NН2. Электронная пара азота, участвуя в сопряжении, становится малоподвижной.
Стабильность сопряженной системы затрудняет присоединение Н+.
Т.о., чем сильнее к-та, тем слабее образуемое ею основание и наоборот.
Контрольные вопросы к теме: «Кислотность и основность»
Что называется кислотой и основанием по теории Бренстеда?
Классификация кислот Бренстеда.
Чем определяется сила кислоты?
Чем определяется стабильность аниона?
От каких факторов зависит делокализация заряда аниона?
Какие амины проявляют более выраженные основные свойства?
Упражнения и ситуационные задачи
Какое соединение имеет более сильные кислотные свойства и почему?
а) CH3 -SH, б) CH3-NH2, в) CH3-OH.
Какая кислота является более сильной и почему?
а) СH3COOH, б) Сl-CH2COOH, в) Cl2- CH – COOH.
Сравните кислотность пропанола, пропантриола и фенола.
Обьясните, почему анилин проявляет более слабые основные свойства, по сравнению с этилламином.
Какое из соединений является более сильной кислотой:
а) пропанол-1; б) пропандиол-1,2; в) пропиламин; г) пропантиол-1. Напишите его реакцию с NaOH.
Какое из соединений является самым слабым основанием?
а) С2Н5–NH2; б) (С2Н5)2–NH; в) С6Н5–NH2; г) NO2–C6H4–NH2. Ответ поясните.
7. Напишите какая из реакций доказывает более сильные кислотные свойства фенола по сравнению со спиртами:
8. Объясните, почему 1-амино-2-метилбензол по сравнению с анилином проявляет более сильные свойства.
В качестве антидота при отравлении солями мышьяка был предложен 2,3-димеркаптопропанол. Объясните, чем определяется его большая кислотность в сравнении с пропантриолом.
Л и т е р а т у р а:
1. Тюкавкина С. 100-101, 108-109.
