
- •Биоорганическая химия
- •Изомерия органических соединений
- •Классификация изомерии
- •Структурная изомерия
- •Пространственная изомерия (стереоизомерия)
- •Конфигурационные изомеры.
- •Лекция 2 Сопряженные системы
- •Классификация органических реакций
- •Лекция 3 Кислотность и основность
- •Кислоты Бренстеда
- •Лекция 4 Спирты
- •Одноатомные спирты Номенклатура:
- •Физические св-ва
- •Карбокатион
- •Лекция 5 Фенолы
- •Строение молекулы амина
- •Замещенный имин
- •Лекция 8
- •Лекция 9 Карбоновые кислоты
- •Мочевина
- •Лабораторно-семинарское занятие № 4 Тема: «Монофункциональные соединения» Свойства спиртов альдегидов, кетонов и фенолов.
- •Лекция 10 Оксо – окси - фенолокислоты
- •Лекция 11 Аминофенолы, аминоспирты, липиды.
- •Классификация
- •Фосфатидная кислота. Фосфатиды
- •Лекция 12. Углеводы (ув)
- •Лекция Аминокислоты (ак)
- •Лекция 14 Белки
- •Лекция 15 Гетероциклические соединения
- •Лекция 16 Нуклеиновые к-ты
- •Лабораторно-семинарское занятие № 5 Тема: «Гетерофункциональные соединения» Свойства спиртов альдегидов, кетонов и фенолов.
- •Примерные тесты по органической химии
- •Билет № 5
- •Билет № 7
- •Билет № 10
- •Билет № 15
- •Билет № 19
- •Билет № 20
- •Раздел III Биоорганическая химия. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 3
Лекция 2 Сопряженные системы
В простейшем случае сопряженные системы – это системы с чередующимися двойными и одинарными связями. Они могут быть открытыми и закрытыми. Открытая система имеется в диеновых углеводородах (УВ).
П
-электрон





 римеры:
римеры:
С 4Н6
4Н6
С

 Н2
= СН – СН = СН2
Н2
= СН – СН = СН2
Бутадиен-1, 3
Все атомы С находится в состоянии sp2 – гибридизации. Четыре негибридные (р-орбитами), перекрываясь между собой, образуют единую электронную систему. Этот вид сопряжения наз-ся , -сопряжением.
С
 2Н3Сl
2Н3Сl
р-электроны
СН2 = СН – Сl
Здесь происходит сопряжение -электронов с р-электронами. Этот вид сопряжения наз-ся р, -сопряжением.
Закрытая система имеется в ароматических УВ.
С6Н6
Б Сопряжение
– процесс энергетически выгодный,
энергия (Е) при этом выделяется. Энергия
сопряжения бутадиена-1,3 составляет 15
кДж/моль, энергия сопряжения бензола
– 228 кДж/моль.
Ароматичность - это понятие, включающее различные свойства ароматических соединений. Условия ароматичности: 1) плоский замкнутый цикл, 2) все атомы С находятся в sp2 – гибридизации, 3) образуется единая сопряженная система всех атомов цикла, 4) выполняется правило Хюккеля: “В сопряжении участвуют 4n+2 -электронов, где n = 1, 2, 3... ”
Простейший представитель ароматических УВ – бензол. Он удовлетворяет всем четырем условиям ароматичности.
Правило Хюккеля: 4n+2 = 6, n = 1.
|
Нафталин |
Нафталин – ароматическое соединение Правило Хюккеля: 4n+2 = 10, n = 2. |
|
|
Пиридин – ароматическое гетероциклическое соединение. |
Взаимное влияние атомов в молекуле
В 1861 г русский ученый А.М. Бутлеров высказал положение: «Атомы в молекулах взаимно влияют друг на друга». В настоящее время это влияние передается двумя путями: индуктивным и мезомерным эффектами.
Индуктивный эффект
Это передача электронного влияния по цепи -связи. Известно, что связь между атомами с различной электроотрицательностью (ЭО) поляризована, т.е. смещена к более ЭО атому. Это приводит к появлению на атомах эффективных (реальных) зарядов (). Такое электронное смещение наз-ся индуктивным и обозначается буквой I и стрелкой .
![]() ,
X
= Наl
,
НО ,
НS
,
NН2
и др.
,
X
= Наl
,
НО ,
НS
,
NН2
и др.
Индуктивный эффект может быть положительным или отрицательным. Если заместитель Х притягивает электроны химической связи сильнее, чем атом Н, то он проявляет – I. I(Н) = О. В нашем примере Х проявляет – I.
Если заместитель Х притягивает электроны связи слабее, чем атом Н, то он проявляет +I. Все алкилы (R = СН3 , С2Н5 и т.д.), Меn+ проявляют +I.
Мезомерный эффект
М езомерный
эффект (эффект сопряжения) – это влияние
заместителя, передаваемое по сопряженной
системе-связей.
Обозначается буквой М и изогнутой
стрелкой . Мезомерный эффект может
быть «+» или «–».
езомерный
эффект (эффект сопряжения) – это влияние
заместителя, передаваемое по сопряженной
системе-связей.
Обозначается буквой М и изогнутой
стрелкой . Мезомерный эффект может
быть «+» или «–».
Выше было сказано, что имеется два вида сопряжения , и р, .
Примеры:
|
Пропен-2-аль |
Альдегидная группа проявляет “– М.” |
|
|
р, -сопряжение Гидроксильная группа –ОН проявляет “+М”. |
Заместитель, притягивающий электроны из сопряженной системы, проявляет –М и наз-ся электроноакцептором (ЭА). Это заместители, имеющие двойную связь

Заместитель, отдающий электроны в сопряженную систему, проявляет +М и называется электронодонором (ЭД). Это заместители с одинарными
связями, имеющие не поделенную электронную пару –ОН, -NH2, -SH галогены и др.
Таблица 1 Электронные эффекты заместителей
|
Заместители |
Ориентанты в С6Н5-R |
I |
М |
|
|
Ориентанты I рода: направляют ЭД заместители в орто- и пара- положения |
+ |
|
|
– |
– |
+ | |
|
– |
– |
+ | |
|
–Н |
– |
+ | |
|
ЭА |
Ориентанты II рода: направляют заместители в мета- положения |
– |
– |
 Примеры:
Примеры:


 Пиридин
Пиридин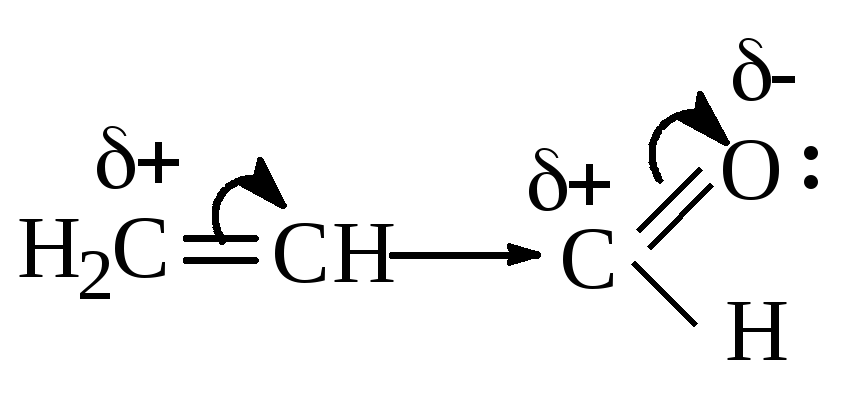
 ,
- сопряжение
,
- сопряжение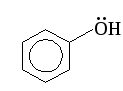 Фенол
Фенол Аlk
(R-): СН3-,
С2Н5-...
Аlk
(R-): СН3-,
С2Н5-...
