- •Биоорганическая химия
- •Изомерия органических соединений
- •Классификация изомерии
- •Структурная изомерия
- •Пространственная изомерия (стереоизомерия)
- •Конфигурационные изомеры.
- •Лекция 2 Сопряженные системы
- •Классификация органических реакций
- •Лекция 3 Кислотность и основность
- •Кислоты Бренстеда
- •Лекция 4 Спирты
- •Одноатомные спирты Номенклатура:
- •Физические св-ва
- •Карбокатион
- •Лекция 5 Фенолы
- •Строение молекулы амина
- •Замещенный имин
- •Лекция 8
- •Лекция 9 Карбоновые кислоты
- •Мочевина
- •Лабораторно-семинарское занятие № 4 Тема: «Монофункциональные соединения» Свойства спиртов альдегидов, кетонов и фенолов.
- •Лекция 10 Оксо – окси - фенолокислоты
- •Лекция 11 Аминофенолы, аминоспирты, липиды.
- •Классификация
- •Фосфатидная кислота. Фосфатиды
- •Лекция 12. Углеводы (ув)
- •Лекция Аминокислоты (ак)
- •Лекция 14 Белки
- •Лекция 15 Гетероциклические соединения
- •Лекция 16 Нуклеиновые к-ты
- •Лабораторно-семинарское занятие № 5 Тема: «Гетерофункциональные соединения» Свойства спиртов альдегидов, кетонов и фенолов.
- •Примерные тесты по органической химии
- •Билет № 5
- •Билет № 7
- •Билет № 10
- •Билет № 15
- •Билет № 19
- •Билет № 20
- •Раздел III Биоорганическая химия. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 3
Лекция 15 Гетероциклические соединения
ГЦС называются молекулы, в цикл которых, кроме атомов углерода, входит один или несколько гетероатомов, чаще всего это N, О, S.

Пиррол Фуран Тиазол Индол Пиримидин Пурин
Биологическая функция
Химия гетероциклических соединений является одним из важных разделов органической химии. Многие жизненноважные сое-ния содержат гетероциклы. Гетероциклы – это ферменты (дегидрогеназа, декарбоксилаза и др.), витамины (В1, В6, В12 и др.), гормоны, алкалоиды, антибиотики (пенициллин). Они входят в состав нуклеиновых к-т (НК): аденин, гуанин, тимин, цитозин, урацил – азотистые основания – материальные носители наследственности.
Гетероциклы составляют основу многих химиотерапевтических препаратов: фурацилин, фурагин – содержат ядро фурана; 5-НОК, энтеросептол – ядро хинолина; антипирин, амидопирин – ядро пиразола, орат калия – ядро пиримидина; рибоксин – ядро пурина.
Номенклатура
Сложна. Поэтому широко используются тривиальные и полутривиальные названия. Некоторые закономерности можно отметить лишь для N-содержащих гетероциклов.
5-членные гетероциклы с двумя гетероатомами, содержащие N, наз-ся азолами. Вид второго гетероатома обозначается приставкой. Например, ОКСА – О-оксазол, тиа – S–тиазол.
6-членные ГЦ с атомом N имеют окончание -ИН. Например, пиридИН, пиримидИН.
Производные гетероциклов называются и по международной, и рациональной номенклатуре.
Нумерацию в кольце начинают с наиболее электроотрицательного гетероатома и продолжают в сторону наименьших номеров, обозначающих другой гетероатом, либо двойную связь, либо функциональную группу.
Если второй гетероатом располагается слева в кольце, то нумерацию ведут по часовой стрелке:




По рациональной номенклатуре атомы, стоящие рядом с гетероатомом, обозначаются буквами греческого алфавита (, , , , и т.д.) и строится название:

3-метилпиридин,
-метилпиридин,
-пиколин
При нумерации конденсированных гетероциклов важно определить главный цикл и атомы, участвующие в конденсации, т.к. они, как правило, не нумеруются. В конденсированных циклах с бензолом главным является ГЦ. В других конденсированных ГЦ главным является ГЦ с большим числом гетероатомов, либо больший ГЦ, если они одинаковы, то главным будет цикл, содержащий азот:

Индол Хинолин Пурин
Пятичленные гетероциклы с одним гетероатомом
Пиррол
 Ароматическое
соединение. Молекула плоская, все атомы
цикла находятся в sр2-гибридизации,
выполняется правило Хюккеля. Двухэлектронная
орбиталь атома N
образует шестиэлектронное облако,
поэтому атом азота не участвует в
образовании связи по донорно-акцепторному
механизму.
Ароматическое
соединение. Молекула плоская, все атомы
цикла находятся в sр2-гибридизации,
выполняется правило Хюккеля. Двухэлектронная
орбиталь атома N
образует шестиэлектронное облако,
поэтому атом азота не участвует в
образовании связи по донорно-акцепторному
механизму.
Пиррол не обладает оснóвными св-вами. Он ацидофобен, т.е. способен протонироваться сильными кислотами, затем полимеризуется и осмоляется.
Атом азота отдает два электрона в -электронную систему кольца, являясь ЭД заместителем I-го рода. Т.о., пиррол – электронноизбыточная система:на 5 атомов цикла приходится 6 электронов, поэтому для него наиболее характерны р-ции SE, они протекают довольно легко.
Смещение электронной плотности от атома N в цикл увеличивает полярность связи N H. Пиррол – слабая кислота.
Химические свойства
I. Кислотно-оснóвные св-ва
В связи с полярностью связи N H пиррол проявляет слабые кислотные св-ва (подобно спиртам). Он образует соли с металлическим калием и 30 % р-ром КОН.
Пирролат
калия
II. Р-ции замещения в цикле
1) Р-ции SE идут, в первую очередь, в положения 2, 5, а затем 3, 4. Это р-ции галоидирования, нитрования, сульфирования, ацилирования, алкилирования.
2) Реакии SN не характерны, т. к. пиррол является электронноизбыточной системой.
+CH3COOH Уксусная
к-та
III.Окислительно-восстановительные св-ва
Пиррол стоек к действию окислителей. При восстановлении (гидрировании) пиррола образуются продукты частичного или полного восстановления:

Пирролидин входит в состав аминокислот (пролин, оксипролин).
Шестичленные гетероциклы
Пиридин
|
|
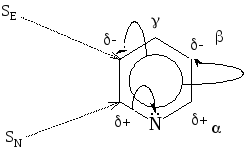
Ароматическое соединение. Молекула плоская, все атомы кольца находятся в sp2 – гибридизации, выполняется правило Хюккеля. Атом азота поставляет в -электронное облако один электрон. Т.к. атом азота более электроотрицателен, чем атом углерода, то электронная плотность кольца смещается к нему, он выполняет роль заместителя (ЭА) II-го рода. Неподеленная пара электронов гибридной р-орбитали свободна, поэтому пиридин проявляет оснóвные св-ва и не проявляет кислотные. |
Р-ции SE протекают с трудом в - положения, р-ции SN протекают легче и преимущественно в – положения.
Химические свойства
I Р-ции замещения в цикле
Р-ции SЕ (нитрование, сульфирование, галоидирование)

–NO2, –SO3H, –Br группы входят в 3,5 – положения, как и для бензола с ЭА заместителем.
Р-ции SN
..
II.Кислотно-оснóвные св-ва
Атом азота имеет неподеленную электронную пару на гибридной орбитали, поэтому подобно аминам пиридин проявляет оснóвные св-ва, образуя
соли с кислотами, и нуклеофильные св-ва, присоединяя другую положительную частицу:



III. Окислительно-восстановительные св-ва
Наличие сопряженной системы делает пиридин стойким к действию окислителей. Однако гомологи окисляются легко, образуя к-ты:

Р-ция восстановления, как и бензола, протекает в жестких условиях:

Пиперидин входит в состав анестетика промедола. Производные пиридина: алкалоиды, витамины В1, РР, ферменты, лекарственные противотуберкулезные и др. препараты:
|
|
|
|
|
|
Никотиновая к-та, Витамин РР |
Тубазид |
Фтавизид |
Кордиамин |
Шестичленные гетероциклы с двумя гетероатомами
Из этой группы наиболее важным являются гетероциклы, содержащие два атома N. Они имеют общее название диазины и различаются взаимным расположением атомов N:
|
|
|
. Наличие двух атомов N в кольце еще больше, чем в пиридине, понижает электронную плотность на атомах углерода. Это приводит к снижению реакционной активности диазинов в р-циях SE и, напротив, облегчает р-ции SN по сравнению с пиридином. При этом уменьшаются и оснóвные св-ва диазинов. Они являются очень слабыми основаниями и образуют соли только с одним эквивалентом сильной к-ты, несмотря на наличие двух центров основности.
Среди производных диазинов, имеющих биологическое значение и применяемых в медицине, наиболее важными являются гидрокси- и аминопроизводные пиримидина. К ним, в первую очередь, относятся нуклеиновые основания и барбитуровая к-та.
Пиримидиновые нуклеиновые основания
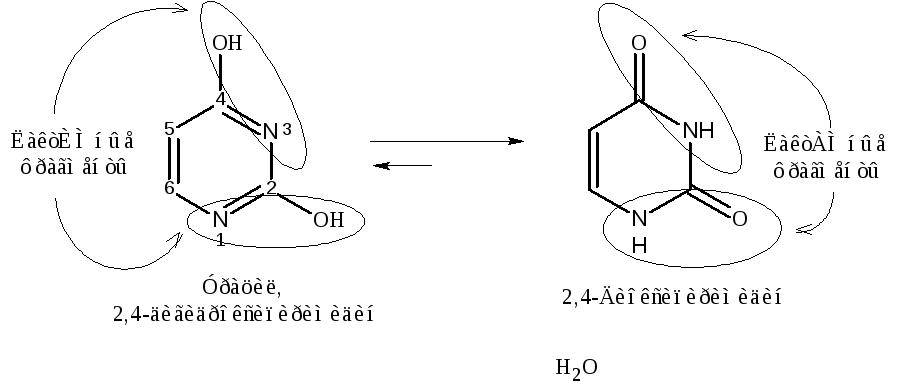
Производные пиримидина – урацил, тимин и цитозин – называются нуклеиновыми основаниями, т.к. являются компонентами нуклеиновых к-т (НК). Эти производные существуют в лактимной и лактамной таутомерных формах, причем в равновесной системе преобладают лактамные формы:
5 – Фторурацил – противораковое средство

Тимин, 2,4-диокси-5-метилпиримидин, 5-метилурацил 2,4-Диоксо-5-метилпиримидин



Барбитуровая к-та
Она может существовать в нескольких таутомерных формах, из которых изобразим только три:
 Барбитуровая
к-та проявляет сразу два вида таутомерии
лактим-лактамную и кето-енольную.
Следовательно, структуру барбитуровой
к-ты можно представить и как 2,4,6 –
тригидроксипиримидин (тригидроксиформа),
и как 2,4,6 – триоксопиримидин
(триоксоформа).Преобладающий таутомер
– триоксоформа. Подвижность атомов
водорода, особенно в енольной гидроксильной
группе обусловливает кислотные св-ва
барбитуровой к-ты, которая является,
более сильной, чем уксусная.
Барбитуровая
к-та проявляет сразу два вида таутомерии
лактим-лактамную и кето-енольную.
Следовательно, структуру барбитуровой
к-ты можно представить и как 2,4,6 –
тригидроксипиримидин (тригидроксиформа),
и как 2,4,6 – триоксопиримидин
(триоксоформа).Преобладающий таутомер
– триоксоформа. Подвижность атомов
водорода, особенно в енольной гидроксильной
группе обусловливает кислотные св-ва
барбитуровой к-ты, которая является,
более сильной, чем уксусная.
Производные барбитуровой к-ты, содержащие заместители у атома С–5, наз-ся барбитуратами и применяются в качестве снотворных средств:
|
Натриевая
соль барбитуратов |
|
Барбитураты
Для барбитуратов невозможна кето-енольная таутомерия, т.к. в молекуле отсутствуют атомы водорода при С–5. Барбитураты проявляют более слабые кислотные св-ва, чем свободная барбитуровая к-та, и со щелочами образуют водо-растворимые соли.
Конденсированные гетероциклические соединения
Важнейшая конденсированная система пурин состоит из двух сочлененных колец – имидазола и пиримидина. Пурин – ароматическое соединение: имеет плоский цикл, все атомы цикла находятся в sp2 – гибридизации, сопряженная система, состоящая из 10 р–электронов, включая неподеленную пару электронов у атома N-9, что отвечает правилу Хюккеля (4n+2=10, n=2).
|
|
Пурин – бесцветное кристаллическое вещ-во, т. пл. 216-2170С, хорошо растворимо в воде, плохо – в эфире, хлороформе. Пурин амфотерен благодаря циклу имидазола и образует соли с сильными к-тами за счет пиридиновых атомов азота и с основаниями за счет –NH кислотного центра имидазола. |
Пуриновая система входит в состав многих биологически важных соединений: нуклеиновых кислот, витаминов, алкалоидов, лекарственных средств. К наиболее значимым производным пурина относятся гидрокси- и –аминопурины.
Пуриновые нуклеиновые основания
В состав НК входят нуклеиновые основания аденин и гуанин. Из двух таутомерных форм гуанина (лактимная и лактамная) более устойчивой является лактамная, в виде которой гуанин входит в состав НК.
Лактимная
форма Лактамная
форма

![]()


2-Амино-6-оксопурин
Следует отметить, что в отличие от самого пурина атом водорода в аденине и гуанине зафиксирован в положении 9. В такой форме эти основания связаны с остатком углевода в нуклеозидах и НК.
Гидроксипроизводные пурина
Это гипоксантин, ксантин и мочевая к-та – продукты превращения в организме нуклеиновых кислот.
|
Гипоксантин, 6-гидроксипурин |
Ксантин, 2,6-дигидроксипурин |
Мочевая к-та, 2,6,8-тригидроксипурин
|
Для гидроксипуринов возможна лактим – лактамная таутомерия, однако в кристаллическом состоянии они существуют преимущественно в лак
тамной форме. У ксантинов возможна также миграция атома водорода между атомами азота в положениях 7 и 9 имидазольного кольца.
Мочевая к-та плохо растворима в воде и содержится в моче человека и млекопитающих в незначительных количествах. При некоторых нарушениях обмена вещ-в мочевая к-та и ее соли (ураты) откладываются в виде так называемых камней.
Контрольные вопросы к теме: «Гетероциклические соединения»
Какие соединения называются гетероциклами.
Классификация гетероциклических соединений.
Дайте характеристику химическим свойствам пиррола, с точки зрения электронного строения. Докажите, что пиррол является ароматическим соединением.
С точки зрения электронного строения охарактеризуйте химические свойства пиридина. Объясните, почему пиррол проявляет кислотные свойства, а пиридин основные свойства.
Какие основания пиримидина и пурина называются нуклеиновыми основаниями.
Какие виды таутомерии возникают в барбитуровой кислоте.
Упражнения и ситуационные задачи:
Напишите реакции, характерные для пиррола. Объясните почему он проявляет слабые основные свойства.
Напишите реакции SN и SЕ для пиридина.
Пиперидин входит в состав анестетика промедола. Напишите реакцию его образования.
Изобразите кето-енольную и лактим-лактамную таутомерию в барбитуровой кислоте.
Покажите лактим-лактамную таутомерию на пиримидиновых основаниях.
Конечным продуктом пуринового обмена в организме является мочевая кислота. При почечнокаменной болезни мочевая кислота и её соли выпадают в форме кристаллического осадка. Напишите формулу этой кислоты.
Л и т е р а т у р а
1. Тюкавкина С. 275–304, 307.