
- •Биоорганическая химия
- •Изомерия органических соединений
- •Классификация изомерии
- •Структурная изомерия
- •Пространственная изомерия (стереоизомерия)
- •Конфигурационные изомеры.
- •Лекция 2 Сопряженные системы
- •Классификация органических реакций
- •Лекция 3 Кислотность и основность
- •Кислоты Бренстеда
- •Лекция 4 Спирты
- •Одноатомные спирты Номенклатура:
- •Физические св-ва
- •Карбокатион
- •Лекция 5 Фенолы
- •Строение молекулы амина
- •Замещенный имин
- •Лекция 8
- •Лекция 9 Карбоновые кислоты
- •Мочевина
- •Лабораторно-семинарское занятие № 4 Тема: «Монофункциональные соединения» Свойства спиртов альдегидов, кетонов и фенолов.
- •Лекция 10 Оксо – окси - фенолокислоты
- •Лекция 11 Аминофенолы, аминоспирты, липиды.
- •Классификация
- •Фосфатидная кислота. Фосфатиды
- •Лекция 12. Углеводы (ув)
- •Лекция Аминокислоты (ак)
- •Лекция 14 Белки
- •Лекция 15 Гетероциклические соединения
- •Лекция 16 Нуклеиновые к-ты
- •Лабораторно-семинарское занятие № 5 Тема: «Гетерофункциональные соединения» Свойства спиртов альдегидов, кетонов и фенолов.
- •Примерные тесты по органической химии
- •Билет № 5
- •Билет № 7
- •Билет № 10
- •Билет № 15
- •Билет № 19
- •Билет № 20
- •Раздел III Биоорганическая химия. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 3
Лекция 14 Белки
Это биополимеры, состоящие из ста и более АК остатков.
Классификация: простые белки (протеины), состоящие из -АК, сложные белки (протеиды), состоящие из белковой и небелковой частей.
Аминокислотный состав определяет многие св-ва белков: заряд белковой молекулы, ИЭТ, способность к осаждению, структуру и биологическую активность.
В настоящее время синтезированы простейшие белки – инсулин, рибонуклеаза, окситацин и др.
Первичная структура
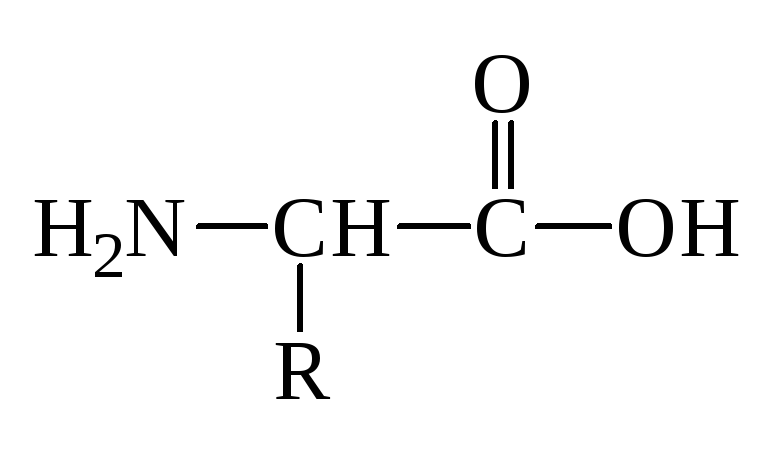
При всем многообразии пептидов и белков принцип построения их молекул одинаков – связь между -АК осуществляется за счет –СООН гр. одной АК и –NH2 гр. другой АК, которая в свою очередь своей карбоксильной группой связывается с аминогруппой третьей АК и т.д. Связь между остатками АК, а именно между группой С=О одной к-ты и группой NH другой к-ты, является амидной связью. В химии пептидов и белков она наз-ся пептидной связью:




![]()





Пептидная связь
N-конец С-конец
Формально белковая или пептидная цепь представляет собой продукты поликонденсации АК. Один из концов цепи, где находится остаток АК со свободной аминогруппой, наз-ся N-концом (а сама АК – N–концевой), а другой конец цепи с остатком АК, имеющим свободную карбоксильную группу, наз-ся С–концом (а к-та - С-концевой). Т.о., пептидная цепь построена из повторяющихся скелет молекулы, и отдельных боковых групп – радикалов R, R/,R//.
Первичная структура пептидов и белков – это последовательность аминокислотных остатков в полипептидной цепи.
Сведения о последовательности -АК остатков в цепи могут быть получены в результате постепенного, шаг за шагом, отщепления АК с одного конца цепи последующей идентификацией отщепленной -АК. Такие методы существуют, и с их помощью установлена первичная структура многих пептидов и белков.
Для синтеза белка важен не только набор АК, но и порядок их соединения, т.е. первичная структура. Последняя обусловливает активность белков. Определенную последовательность АК в цепи дает использование операции “защита”.
"Защита” –NH2 гр. проводится методом ацилирования АК хлорангидридом или ангидром к-ты или на практике карбобензоксихлоридом (бензиловым эфиром хлормуравьиной к-ты):

АК
Ацилхлорид
“Защита” –СООН гр. проводится путем образования сложного эфира:

Затем проводят р-цию взаимодействия защищенных молекул в присутствии водоотнимающих средств. В этих условиях реагируют строго определенные группы –СООН первой молекулы и –NH2 – второй:

![]()
Пептидная
связь



Затем проводят гидролиз в мягких условиях с освобождением защищенных групп и сохранением пептидной связи:

Вторичная структура
Цепи пептидов и белков принимают в пространстве определенную более или менее компактную форму. Уникальная особенность белковых молекул заключается в том, что они имеют, как правило, четкую пространственную структуру, или конформацию. В данном случае понятие конформации применяется для пространственного строения длинных полипептидных цепей. Как только молекула окажется развернутой или уложенной иным способом в пространстве она почти всегда теряет свою биологическую функцию.
Л.Полинг, Р.Кори (1951) на основании расчетов предсказали наиболее выгодные способы укладки цепей в пространстве.
Пептидная цепь может укладываться в виде спирали (подобно винтовой лестницы). В одном витке спирали помещается около четырех АК остатков. Закрепление спирали обеспечивается водородными связями между группами С=О и NН, направленными вдоль оси спирали. Все боковые радикалы R АК находятся снаружи спирали. Такая конформация наз-ся -спиралью. Другой вариант упорядоченной структуры полипептидной цепи – -структура, или -складчатый слой. В этом случае скелет находится в зигзагообразной конформации, и цепи располагаются параллельно друг другу, удерживаясь Н-связями.
Вторичная структура белка – это более высокий уровень структурной организации, в котором закрепление конформации происходит за счет Н-связей между пептидными группами.
Конформация белковой молекулы стабилизируется не только Н-связями, но и за счет некоторых ионных взаимодействий, а также за счет окисления SН-групп боковых радикалов R возникает ковалентная дисульфидная связь.
Третичная структура
Это укладка полипептидной цепи, включающей элементы той или иной вторичной структуры в пространстве, т.е. образование трехмерной конфигурации белка.
Чаще
всего это – клубок. Стабилизируют
третичную структуру Н-связи,
электростатическое взаимодействие
заряженных групп, межмолекулярные силы
Ван дер Ваальса, гидрофобные взаимодействия
– вызванные вталкиванием радикалов R
внутрь молекулы белка молекулами воды.
Н-связь
Четвертичная структура
Несколько отдельных полипептидных цепей способны укладываться в более сложные образования, называемые также комплексами или агрегатами. При этом каждая цепь, сохраняя характерную для нее первичную, вторичную и третичную структуры, выступает в роли субъединицы комплекса с более высоким уровнем пространственной организацией – четвертичной структурой. Такой комплекс представляет собой единое целое и выполняет биологическую функцию, не свойственную отдельно взятым субъединицам. Четвертичная структура закрепляется за счет Н-связей и гидрофобных взаимодействий между субъединичными полипептидными цепями.
Денатурация белков
Под влиянием многих факторов пространственная структура способна разрушаться, что приводит к потере биологической активности белков. К таким факторам относятся повышенная температура, изменение рН среды, УФ – и рентгеновское излучения, механическое воздействие (встряхивание), соли тяжелых Ме, алкалоиды и др.
Денатурация белков – это разрушение их природной (нативной) пространственной структуры с сохранением первичной структуры. Денатурация
]
редко бывает обратимой. В этих немногих случаях важно то, что беспорядочно скрученная молекула денатурированного белка самопроизвольно при
нимает нативную пространственную структуру с полным сохранением биологической функции.
В случаях отравления солями тяжелых Ме (ртути, свинца, серебра и др.) в качестве противоядия используют белки с повышенным содержанием кислотных групп, например яичный альбумин. Он действует как конкурент белков организма и сам связывает токсичный агент, образуя с ним нерастворимую соль, которая затем выводится из организма.
В организме содержится более 50.000 различных белков. Кожа содержит 63% от массы сухой ткани, кости – 20%, зубы – 18%.
Функции белков:
Питательная (энергетическая – 20-25% – на белки), 17,6 кДж/г.
Транспортная (переносчики различных веществ) – гемоглобин, миоглобин и др.
Сократительная (белки мышечных тканей) – миозин и др.
Структурная (пластическая) – коллаген, фиброин, мембранные белки.
Каталитическая (белки-ферменты) – пепсин, каталаза, уреаза и др.
Регуляторная (белки-гормоны) – инсулин, вазопрессин и др.
Защитная (белки-антитела) – -глобулины сыворотки крови.
Осмотическая, буферная, водно-солевая.
Контрольные вопросы к теме: «Аминокислоты и белки»
Какие соединения называются аминокислотами.
Какие амнокислоты являются заменимыми, а какие не заменимые.
Номенклатура и изомерия аминокислот.
Классификация аминокислот.
Охарактеризуйте взаимное влияние NH2 и СООН групп на химические свойства кислот.
Что называется биполярным ионом.
Какие соединения называются белками.
Функции белков в организме.
Строение белков (первичная, вторичная, третичная и четвертичная структура).
Какой процесс называется денатурацией белков.
Упражнения: и ситуационные задачи.
Напишите энантиомера для аланина. Укажите D- и L-форму.
При врождённой форме слабоумия отмечается нарушения обмена фенилаланина. Напишите качественную реакцию на эту аминокислоту.
Глицин уменьшает психоэмоциональное напряжение, повышает умственную работоспособность, облегчает засыпание и нормализует сон. Напишите взаимодействие глицина с NaOH, CH3OH, PCl5, NH3.
γ-аминомасляная кислота содержится в центральной нервной системе и принимает участие в обменных процессах головного мозга. Под её влиянием усиливаются энергетическеи процессы, повышается дыхательная активность тканей головного мозга. Напишите реакцию образования лактама из γ-аминомасляной кислоты. Дайте название продукту.
Путём йодирования тирозина в организме образуется гормон щитовидной железы – тироксин. Напишите реакцию его образования.
Напишите синтез из дипептида глицилаланина с использованием операции «защита». Укажите пептидную связь.
Напишите реакцию образования диполярного иона глицина и его реакцию с гидроксидом меди (II).
Напишите проекционную форму L-аланина и его реакции с этиловым спиртом и хлорангидридом уксусной кислоты.
Обмен серы в организме идет, в основном, за счет цистина и цистеина. Напишите качественную реакцию на серосодержащие аминокислоты
Напишите реакцию, доказывающую наличие в белках пептидной связи.
Л и т е р а т у р а
Тюкавкина С. 1. Тюкавкина С. 313–343, 344–356, 361–376.
