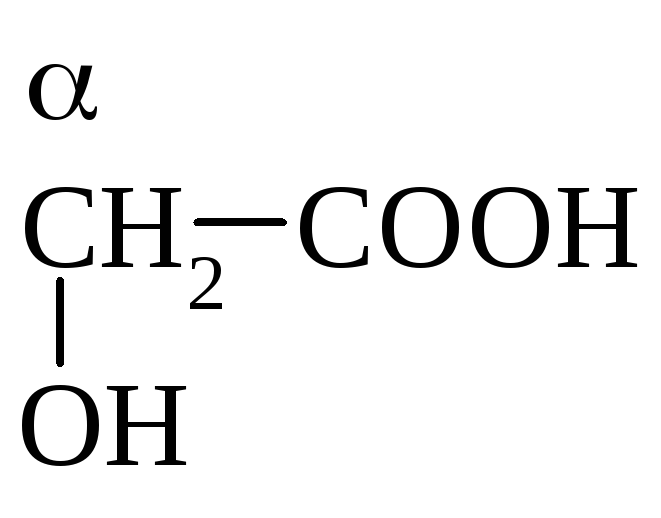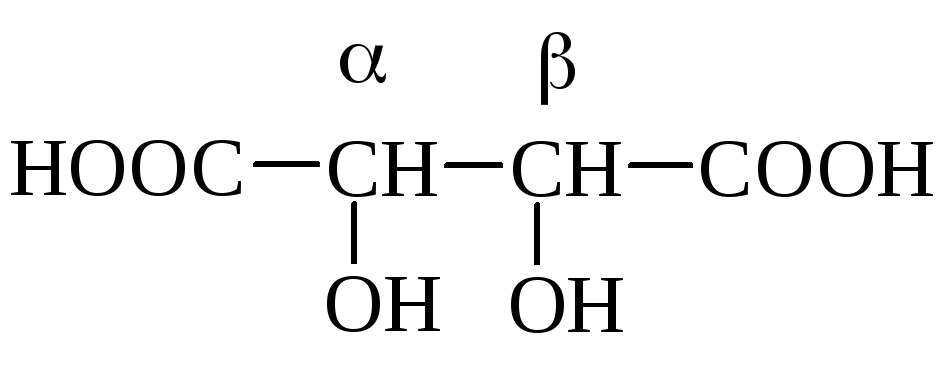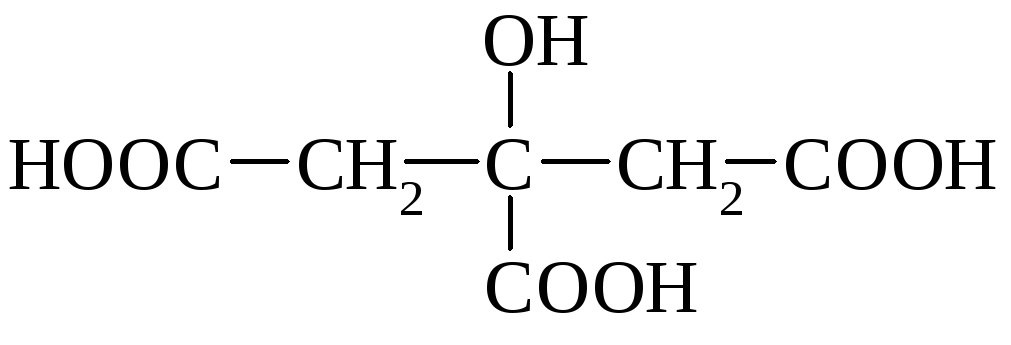- •Биоорганическая химия
- •Изомерия органических соединений
- •Классификация изомерии
- •Структурная изомерия
- •Пространственная изомерия (стереоизомерия)
- •Конфигурационные изомеры.
- •Лекция 2 Сопряженные системы
- •Классификация органических реакций
- •Лекция 3 Кислотность и основность
- •Кислоты Бренстеда
- •Лекция 4 Спирты
- •Одноатомные спирты Номенклатура:
- •Физические св-ва
- •Карбокатион
- •Лекция 5 Фенолы
- •Строение молекулы амина
- •Замещенный имин
- •Лекция 8
- •Лекция 9 Карбоновые кислоты
- •Мочевина
- •Лабораторно-семинарское занятие № 4 Тема: «Монофункциональные соединения» Свойства спиртов альдегидов, кетонов и фенолов.
- •Лекция 10 Оксо – окси - фенолокислоты
- •Лекция 11 Аминофенолы, аминоспирты, липиды.
- •Классификация
- •Фосфатидная кислота. Фосфатиды
- •Лекция 12. Углеводы (ув)
- •Лекция Аминокислоты (ак)
- •Лекция 14 Белки
- •Лекция 15 Гетероциклические соединения
- •Лекция 16 Нуклеиновые к-ты
- •Лабораторно-семинарское занятие № 5 Тема: «Гетерофункциональные соединения» Свойства спиртов альдегидов, кетонов и фенолов.
- •Примерные тесты по органической химии
- •Билет № 5
- •Билет № 7
- •Билет № 10
- •Билет № 15
- •Билет № 19
- •Билет № 20
- •Раздел III Биоорганическая химия. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 3
Лекция 10 Оксо – окси - фенолокислоты
Это соединения, содержащие разные функциональные группы. Они имеют большое значение, т.к. многие из низ являются биологически активными и лекарственными веществами.
В зависимости от сочетания функциональных групп различают гидрокси- (окси-), -альдегидо (оксо-), феноло-, аминокислоты и др.
Каждая из гетерофункциональных групп сохраняет свою собственную реакционную способность. При достаточно близком расположении происходит усиление реакционной способности каждой из них.
Молекулы некоторых гетерофункциональных соединений вступают в р-ции внутри- и межмолекулярного взаимодействия.
Гидрокси-, или оксикислоты
Это соединения, содержащие одну или несколько групп –ОН и –СООН.
В общем
виде их формулу можно представить
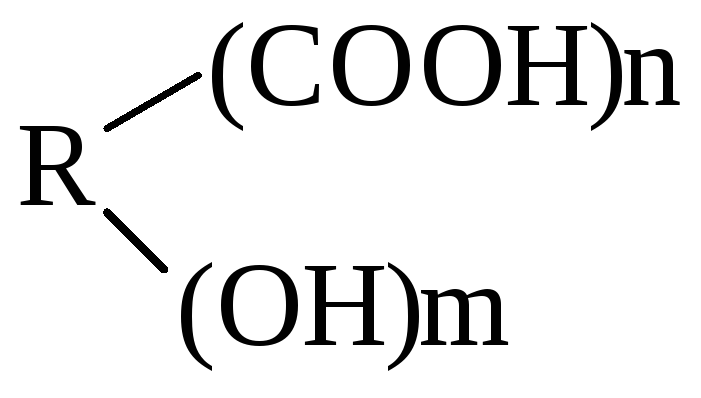 .
В простейшем случае n
= m
= 1. Количество гр. –СООН определяет
основность, а гр. –ОН – атомность.
.
В простейшем случае n
= m
= 1. Количество гр. –СООН определяет
основность, а гр. –ОН – атомность.
Номенклатура
|
|
гликолевая к-та, -оксиуксусная к-та, 2-гидроксиэтановая к-та
|
|
|
молочная к-та, -оксипропионовая к-та, 2-оксипропановая к-та |
|
|
винная к-та, ,-диоксиянтарная к-та, 2,3-диоксибутандиовая к-та |
|
|
лимонная к-та, 3-гидрокси- 3-карбоксипентандиовая к-та |
|
|
салициловая к-та, -оксибензойная к-та, 2-оксибензойная к-та |
|
|
галловая к-та, 3,4,5-триоксибензойная к-та |
Изомерия
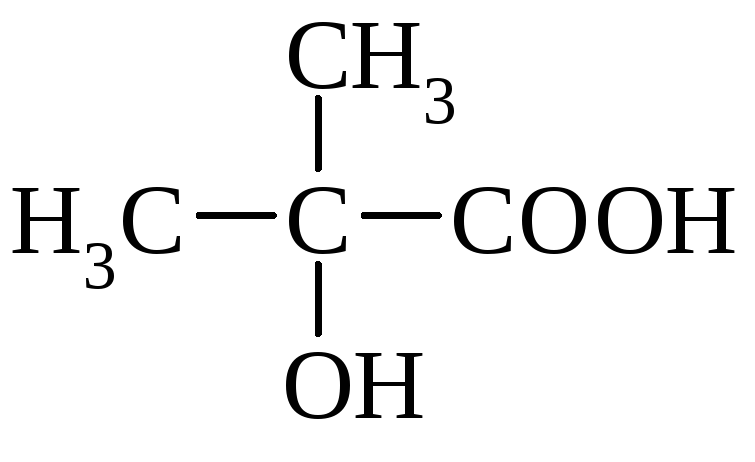
Молекулы с тремя атомами углерода проявляют изомерию положения гр. –ОН, а с четырьмя – изомерию положения и углерод – углеродной цепи. Например,
|
|
|
| ||
|
-оксимасляная к-та |
-оксимасляная к-та |
-оксимасляная к-та | ||
|
|
-оксиизомасляная к-та |
| ||
В молочной к-те появляется асимметрический (хиральный) атом С, а следовательно, имеются оптические изомеры. Оптическая изомерия характерна для многих оксикислот.

L-(+) – Молочная к-т D-(–) – Молочная к-та
Винная к-та имеет два асимметрических атома С. Однако всего изомеров только три, а не четыре (2n), и оптически активных лишь два, т.к. два одинаковых заместителя (гр. –ОН) создают в молекуле плоскость симметрии.


D-(+) – Винная к-та L-(–) – Винная к-та
Знак вращения плоскости поляризации света нельзя связывать с отнесением соединений к D – и L – рядам. Знак «+» и «–» определяют прибором - поляриметром. Для соединений с двумя асимметрическими атомами С определение принадлежности к D – и L – ряду затруднено. По договоренности определяют D – и L – ряды по близлежащему заместителю от старшей функциональной группы, а в углеводах – по положению заместителя у дальнего от старшей функциональной группы атома С.
Химические свойства
Наличие в молекуле двух функциональных групп приводит к тому, что эти соединения проявляют характерные р-ции как для кислот, так и для спиртов.
За счет взаимного влияния двух групп происходит усиление реакционной способности каждой из них. Кроме того для них возможны специфические р-ции с участием обеих групп.

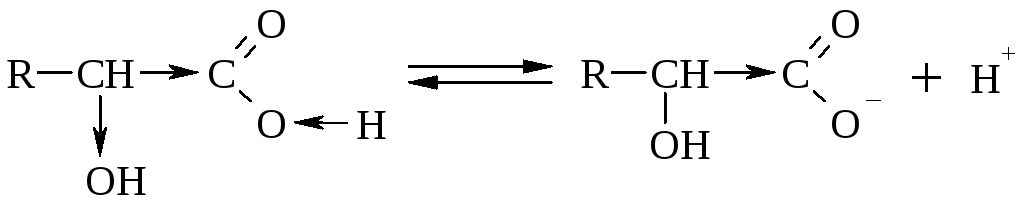
I.Р-ции по гр. –СООН
Оксик-ты диссоциируют, образуют соли, сложные эфиры, амиды, ангидриды, галогенангидриды.
|
1) |
|
|
|
Молочная к-та Лактат-анион |
Окси-ты являются более сильными к-тами, чем соответствующие им карбоновые к-ты, что находит объяснение в ЭА характере групп – ОН и – СООН. Например, -оксиуксусная к-та в 5 раз сильнее уксусной к-ты.
Соли образуются легко с различными веществами Ме, МеО, МеОН, МеСО3, где Ме – активный металл.
|
2) |
|
|
|
Молочная к-та Лактат натрия
|
Двухосновные к-ты образуют средние и кислые соли. Кислые соли, как правило, мало растворимы в воде, средние – хорошо растворимы. Это используют для обнаружения ионов К+ в фармацевтии и в аналитической химии:

Винная к-та Гидротартрат калия
Смешанная К–Na соль винной к-ты наз-ся сегнетовой солью.
Номенклатура солей
Молочной к-ты – лактаты, яблочной – малаты,
Винной – тартраты, лимонной – цитраты.
|
3) |
|
|
|
Молочная к-та
|
II. Р-ции по гр. –ОН
Это р-ции образования алкоголятов, простых и сложных эфиров, галогенопроизводных [НС1 (газ), РС15, SOC12], р-ции окисления (смотри тему «Спирты»)
|
1) |
|
|
|
-гидроксимасляная к-та Ацетоуксусная к-та (АУК) |
Ацетон, ацетоуксусная к-та и -гидроксимасляная к-та составляют группу «ацетоновых тел», образующихся в большом количестве в организме при сахарном диабете.

Яблочная к-та Щавелевоуксусная к-та (ЩУК)
АУК и ЩУК являются естественными продуктами обмена веществ. В организме образуются при участии кофермента НАД+. Окисление происходит очень легко.
Образование сложного эфира при действии хлорангидрида к-ты:
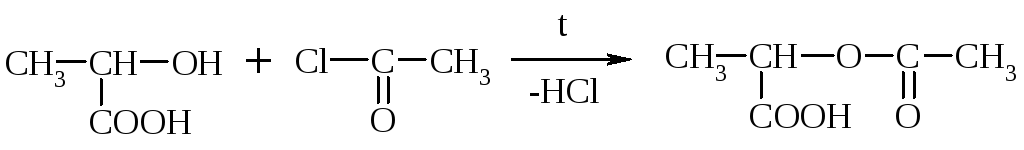
При действии Na и РС15 р-ция пойдет по двум группам.
Винная к-та и ее производные дают качественную р-цию на диольный драгмент – характерное ярко-синее окрашивание – с р-ром Сu(ОН)2 в щелочной среде.

Образовавшееся комплексное соединение под названием реактива Фелинга используется для обнаружения алифатических альдегидов.
III. Специфические р-ции
Они представляют наибольший интерес, т.к. обусловлены взаимным влиянием гетерофункциональных групп.
1) Р-ции дегидратации -, -, -оксикислот
Вследствие наличия групп, способных взаимодействовать друг с другом, молекулы гетерофункциональных соединений способны вступать в р-ции внутри- и межмолекулярного взаимодействия с образованием циклических и нециклических соединений.
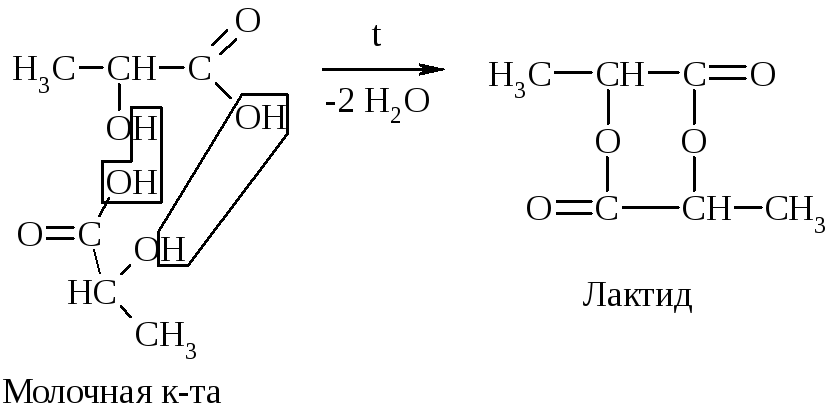
а) Две молекулы -оксик-ты при нагревании выделяют две молекулы воды и образуются лактиды:
б) -оксик-та, в молекуле которой фрагмент – СН2 – находится между двумя ЭА группами, увеличивающих подвижность атомов Н, подвергается дегидратации с образованием непредельной к-ты:

Яблочная к-та ведет себя как -к-та и при дегидратации превращается в фумаровую:

Яблочная к-та Фумаровая к-та
Эфиры фумаровой кислоты применяются при лечении псориаза, т.к., при этом заболевании нарушается превращение янтарной кислоты в фумаровую.
в) -, - и т.д. оксик-ты, в которых две функциональные группы находятся рядом идет внутримолекулярная этерификация с образованием лактона:

-Масляная к-та -Бутиролактон
Лактиды и лактоны являются циклическими сложными эфирами и легко гидролизуются в присутствии щелочей с образованием солей:

-Бутиролактон 4-Гидроксибутаноат натрия
2) Наличие двух ЭА групп у одного атома С приводит -оксик-ты к декарбоксилированию:

Молочная к-та Этанол
В организме эта р-ция протекает под действием фермента.
В присутствии сильных минеральных к-т углеродный скелет -оксик-т расщепляется по связи С–1 – С–2 с образованием карбоксильного соединения (альдегида или кетона) и муравьиной к-ты:

-Оксик-та Альдегид Муравьиная к-та
Особый интерес представляет поведение лимонной к-ты при нагревании в присутствии минеральных к-т. Как -оксик-та она отщепляет НСООН, СО2, образуя в итоге ацетон:

Как -оксик-та она дегидратируется, образуя цис- аконитовую к-ту, участвующую в обмене веществ:

Аконитовая к-та
При этих процессах выделяется энергия. Процесс последовательных превращений лимонной и других к-т в организме наз-ся циклом Кребса.
Отдельные представители
|
|
Гликолевая к-та содержится в незрелом винограде, свекле и др. |
|
|
Тиогликолевая к-та восстанавливает в белках S–S мостики цистина в цистеин в организме. |
|
|
Молочная к-та содержит один асимметрический атом С, в связи с этим существует в виде пары, энантиомеров. Кроме того, известна рацемическая молочная к-та. |
Все три формы встречаются в природе. Рацемическая оптически неактивная молочная к-та (кристаллы) образуется из углеводов в результате молочнокислого брожения под действием бактерий. Получить безводную молочную к-ту очень трудно, т.к. обезвоживание ее р-ров сопровождается образованием лактида. Она образуется при скисании молока, квашении капусты, в различных соленьях, выполняя при этом роль консерванта, т.к. способна препятствовать развитию гнилостных бактерий.
Левовращающая D–молочная к-та образуется также в результате молочнокислого брожения, но под действием других бактерий нежели рацемическая молочная к-та. Правовращающая L–молочная к-та образуется в живых организмах в результате расщепления углеводов. Особенно много ее накапливается в мышцах при больших физических нагрузках.
Соли и эфиры молочной к-ты наз-ся лактатами.
В медицине используется как прижигающее (80%-ный р-р) при выведении мозолей, бородавок, пигментных пятен.
Лактат железа (II) (СН3СНОНСОО)2Fе 3Н2О хорошо всасывается в кишечнике и хорошо переносится больными при анемии.
Лактат кальция применяют внутрь в тех же случаях, что хлорид и глюканат кальция.
Н
*
Н
* *
НООССН(ОН)СН(ОН)СООН винная к-та В природе встречается только D-(+)-винная к-та, содержащаяся во многих растениях, особенно много ее в винограде, который служит сырьем для ее получения. Выделяется в виде малорастворимой кислой калиевой соли («винный камень») в процессе винного брожения виноградного сока. Винная к-та в смеси с содой NaНСО3 под названием «шипучие порошки» применяются как слабительное средство.
НООС-СН-2С(ОН)(СООН)СН2-СООН лимонная к-та (3-гидрокси-3 карбокси-пентандиовая к-та) – бесцветное кристаллическое вещество, хорошо растворимое в воде. Содержится в различных растениях. Впервые была выделена известным химиком К. Шееле (1742–1786) из лимонного сока, где ее содержание достигает 10%. В промышленности получают путем лиминнокислого брожения отходов сахарного производства.
Соли и сложные эфиры лимонной к-ты наз-ся цитратами. Цитрат натрия применяется для консервирования донорской крови. Противосвертывающее действие основано на том, что цитрат натрия связывает ионы кальция в нерастворимый цитрат. Цитрат железа (II) – при анемии.
Фенолокислоты
Из ароматических гидроксик-т наибольшее значение имеют фенолок-ты, у которых гидроксильные группы непосредственно связаны с бензольным кольцом (фенольные гидроксильные группы).
Изомерия фенолок-т обусловлена взаимным расположением –ОН и –СООН групп.
В названиях фенолок-т по МН за родоначальную структуру принята бензойная к-та; наличие –ОН группы отражается префиксом гидрокси-
(окси-). Для многих фенолокислот употребляются тривиальные названия – салициловая, галловая и др.
Фенолок-ты чаще всего получают прямым карбоксилированием фенолов, т.е. непосредственным введением –СООН группы. Например, при взаимодействии сухого феноксида натрия с СО2, который при обработке минеральной к-той првращается в салициловую к-ту:
|
| ||
|
Феноксид Натрия |
Салицилат натрия |
Салициловая к-та
|
Р-ция протекает по механизму SЕ. Поскольку СО2 является слабым электрофилом, непосредственно в р-цию с фенолом он не ступает. Для активации бензольного кольца фенол превращают в феноксид натрия. Отрицательно заряженный атом кислорода феноксид-иона проявляет значительно более сильные электронодонорные св-ва, чем неионизированная –ОН группа. Поэтому в феноксид-ионе бензольное кольцо обладает большой активностью в р-циях SЕ.

Химические св-ва
Фенолокислоты являются сильными к-тами. Сила к-ты возрастает при образовании внутримолекулярной Н–связи:
 или
или 
Проявляют св-ва и фенолов, и к-т. Салициловая к-та обладает более кислотными св-вами, чем ее мета- и пара-изомеры.
I. Р-ции по –СООН гр.
Они проходят с образованием солей, сложных эфиров, ангидридов, хлорангидридов, амидов.

Метилсалицилат представляет собой бесцветную вязкую нерастворимую в воде жидкость с приятным запахом, используется в медицине в качестве противоревматического средства. Другие производные салициловой к-ты – фенилсалицилат (салол), ацетилсалициловая к-та (аспирин), салицилат натрия и др. – также широко используются в качестве противовоспалительных средств и анальгетиков.

Салол применяется как дезинфицирующее средство при кишечных заболеваниях. Однако в кислой среде желудка он не гидролизуется, а распадается только в кишечнике, поэтому используется также в качестве материала для защитных оболочек некоторых лекарственных средств, которые не стабильны в кислой среде желудка.
II. Р-ции по –ОН гр.
Они проходят с образованием фенолятов (с Ме или МеОН), сложных и простых эфиров.


Ацетилсалициловая к-та как сложный эфир способна гидролизоваться в кислой и щелочной средах.
Поэтому следует учитывать условия хранения, которые должны исключать ее контакт с влагой:

При взаимодействии салициловой к-ты с FеС13 образуется фиолетовая окраска, тогда как ацетилсалициловая к-та, у которой нет свободной –ОН группы, такую р-цию не дает. Это различие используется при определении доброкачественности аспирина.
Фенолокислоты сравнительно легко декарбоксилируются:

Дубильные вещ-ва, содержащиеся в значительных количествах в растениях, включают в свой состав остатки галловой (3, 4, 5-тригидроксибензойной) к-ты. Галловая к-та также легко декарбоксилируется с образованием трехатомного фенола пирогаллола.

За счет групп –ОН галловая к-та проявляет антисептическое св-во, применяется как кровеостанавливающее средство, при ожогах для образования защитной бактерицидной пленки, реактив на алкалоиды, противоядие при отравлении алкалоидами, для синтеза красителей.
III. Р-ции по бензольному кольцу
Фенолокислоты вступают в р-ции SЕ по бензольному кольцу:

При бромировании, нитровании, сульфировании салициловой к-ты заместители поступают в орто- и пара- положения по отношению к –ОН группе и в мета- положение по отношению –СООН гр., т.о. действие двух функциональных групп согласованное.
Оксокислоты
Это карбоновые к-ты, содержащие карбонильную группу. Различают кето- и альдегидо-к-ты.
Номенклатура
Тривиальная, рациональная, международная:
|
|
|
|
|
Глиоксалевая к-та |
Пировиноградная к-та (ПВК), -кетопропионовая, 2-оксопропановая к-та |
Ацетоуксусная к-та (АУК), -кетомасляная к-та, 3-оксобутановая к-та |
Изомерия
кетокислот – это изомерия цепи и
положения гр.
![]() .
.
Оксок-ты могут быть одно-, двух- и многоосновные.
|
|
|
|
-Кетоглутаровая к-та (2-оксо-пентандиовая кислота) |
Щавелевоуксусная к-та (ЩУК), 2-кетоянтарная к-та (2-оксо-бутандиовая кислота)
|
Все указанные к-ты являются естественными продуктами обмена веществ.
Оксок-ты,
имея в молекуле гр. –СООН и
![]() ,
обладают св-вами, характерными для к-т,
альдегидов и кетонов.
,
обладают св-вами, характерными для к-т,
альдегидов и кетонов.
Р-ции по гр. –СООН – смотрите р-ции в разделе оксик-т; оксок-ты диссоциируют, образуют соли, сложные эфиры, ангидриды, хлорангидриды, амиды.
По карбонильной гр. идут р-ции АN, при этом образуются оксимы, гидразоны, оксинитрилы и т.д., т.е. проходят р-ции с Н2, РС15, NH2OH, NH2– NH2, NH2–NH–С6Н5, НСN, НОR, р-ции окисления.
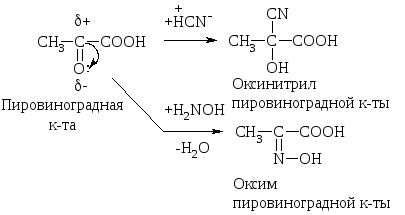
В этом случае р-ции протекают легче, чем для обычных кетонов.
2-оксо-ты окисляются даже такими слабыми окислителями как Сu(ОН)2, при этом образуются две к-ты как и для типичных кетонов:

Это
результат увеличения +
заряда атома С гр.
![]() и объясняет также способность кеток-т
легко декарбоксилироваться. Пировиноградная
к-та при нагревании или действии фермента
декарбоксилазы разлагается:
и объясняет также способность кеток-т
легко декарбоксилироваться. Пировиноградная
к-та при нагревании или действии фермента
декарбоксилазы разлагается:

Ацетоуксусная к-та легко декарбоксилируется как и все -кеток-ты даже при слабом нагревании:

В свою
очередь
![]() группа, оказывая влияние на гр. –СООН,
увеличивает ее кислотность. ПВК в 500 раз
сильнее пропионовой к-ты.
группа, оказывая влияние на гр. –СООН,
увеличивает ее кислотность. ПВК в 500 раз
сильнее пропионовой к-ты.
Для оксок-т характерно существование двух изомерных форм: кетонной и енольной, легко переходящих друг в друга и находящихся в динамическом равновесии. Напомним, что явление существования вещ-ва в виде нескольких изомерных формах, легко переходящих друг в друга и находящихся в подвижном равновесии, наз-ся таутомерией. В зависимости от возникающих групп таутомерия наз-ся по-разному: кето-енольная, лактим-лактамная, прототропная. Для кеток-т характерна кето-енольная таутомерия:
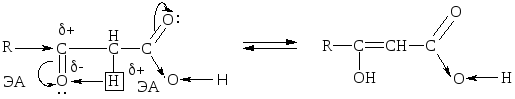
Кето-енольная таутомерия встречается и в обычных альдегидах и кетонах, однако енола содержится в таких системах очень мало ( 2,5 10-5%), т.е. равновесие практически сдвинуто в сторону кетонной формы:

Введение ЭА заместителя у енолизированного атома С, например гр. –СООН, смещает равновесие в сторону енола:

Енольная форма стабилизируется, если двойная С=С связь сопряжена со второй -системой или гр. –ОН участвует в образовании внутримолекулярной Н-связи. Так, этиловый эфир ацетоуксусной к-ты существует уже на 7,5% в енольной форме, т.к. стабилизирован Н-связью:

Смещение равновесия зависит от природы растворителя, температуры (с ее увеличением уменьшается содержание енольной формы) и др. факторов.
Доказательством наличия енольной формы являются р-ции: с Вr2 (водой) – на двойную связь (обесцвечивание), с FeC13 р-ция на –ОН гр. (фиоле
товое
окрашивание); наличие
![]() гр. – р-ции с NH2OH,
NH2–
NH2,
NH2–NH–С6Н5
(образование осадков).
гр. – р-ции с NH2OH,
NH2–
NH2,
NH2–NH–С6Н5
(образование осадков).
Многие р-ции в живых организмах проходят через енольную форму. Так, фосфорный эфир пировиноградной к-ты является важным фосфолирующим и ацилирующим агентом обмена вещ-в:

Контрольные вопросы к теме: «Окси-оксо-фенолокислоты»
Какие соединения называются гетерофункциональными.
Какие соединения называются оксикислотами. Приведите примеры.
Номенклатура и изомерия оксикислот.
Охарактеризуйте взаимное влияние функциональных групп на свойства оксикислот.
Приведите примеры специфических реакций оксикислот.
Какие соединения называются оксокислотами. Приведите примеры.
Номенклатура оксокислот.
На основе взаимного влияния оксо группы и СООН группы охарактеризуйте химические свойства 3-оксобутановой кислоты.
Какие соединения называются фенолокислотами. Приведите примеры.
Упражнения:
Напишите проекционные формулы Фишера стереоизомеров 2,3-диоксибутановой кислоты. Сделайте описание к D- и L- ряду. Укажите энантиомеры, диастереомеры и рацематы.
Напишите реакции молочной кислоты с: а) натрием, б) HCl (газ),
в) PCl5, г) CH3OH, д) NH3, е) раствором KMnO4.
Изобразите два изомера 3-оксобутановой кислоты, используя кето-енольную таутомерию. Напишите качественные реакции этих изомеров с гидразином и бромной водой.
Напишите реакции пировиноградной кислоты (2-оксопропановой кислоты) с: а) HCN, б) NaOH, в) H2N-NH2.
Напишите реакции салициловой кислоты по группе ОН и по СООН.
Напишите реакции салициловой кислоты с бромной водой.
В качестве материала для защитных оболочек некоторых лекарственных средств, которые не стабильны в кислой среде желудка применяется салол (фенилсалицилат). Напишите реакцию его образования.
При лечении ревматоидного артрита применяется метилсалицилат. Напишите реакцию его образования.
Аспирин применяется в течение многих лет, как жаропонижающее средство. Напишите реакцию его образования.
Соли лимонной кислоты (цитраты), применяются для консервирования донорской крови. Напишите реакцию разложения лимонной кислоты.
Л и т е р а т у р а
1. Тюкавкина С. 256–267, 273–274.