- •Биоорганическая химия
- •Изомерия органических соединений
- •Классификация изомерии
- •Структурная изомерия
- •Пространственная изомерия (стереоизомерия)
- •Конфигурационные изомеры.
- •Лекция 2 Сопряженные системы
- •Классификация органических реакций
- •Лекция 3 Кислотность и основность
- •Кислоты Бренстеда
- •Лекция 4 Спирты
- •Одноатомные спирты Номенклатура:
- •Физические св-ва
- •Карбокатион
- •Лекция 5 Фенолы
- •Строение молекулы амина
- •Замещенный имин
- •Лекция 8
- •Лекция 9 Карбоновые кислоты
- •Мочевина
- •Лабораторно-семинарское занятие № 4 Тема: «Монофункциональные соединения» Свойства спиртов альдегидов, кетонов и фенолов.
- •Лекция 10 Оксо – окси - фенолокислоты
- •Лекция 11 Аминофенолы, аминоспирты, липиды.
- •Классификация
- •Фосфатидная кислота. Фосфатиды
- •Лекция 12. Углеводы (ув)
- •Лекция Аминокислоты (ак)
- •Лекция 14 Белки
- •Лекция 15 Гетероциклические соединения
- •Лекция 16 Нуклеиновые к-ты
- •Лабораторно-семинарское занятие № 5 Тема: «Гетерофункциональные соединения» Свойства спиртов альдегидов, кетонов и фенолов.
- •Примерные тесты по органической химии
- •Билет № 5
- •Билет № 7
- •Билет № 10
- •Билет № 15
- •Билет № 19
- •Билет № 20
- •Раздел III Биоорганическая химия. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 3
Мочевина
Впервые была выделена из мочи, является конечным продуктом распада белков у животных. Взрослый человек в сутки выделяет с мочой 25 – 30 г мочевины.
Мочевина является производным угольной кислоты.
В промышленности мочевину получают:
 Большая
часть ее используется в качестве азотного
удобрения. Значительное количество ее
расходуется на получение
мочевиноформальдегидных смол, имеющих
большую роль в технике.
Большая
часть ее используется в качестве азотного
удобрения. Значительное количество ее
расходуется на получение
мочевиноформальдегидных смол, имеющих
большую роль в технике.
Мочевина – бесцветное кристаллическое в-во (т. пл. 133 оС), хорошо растворима в воде, обладает оснóвными св-вами.
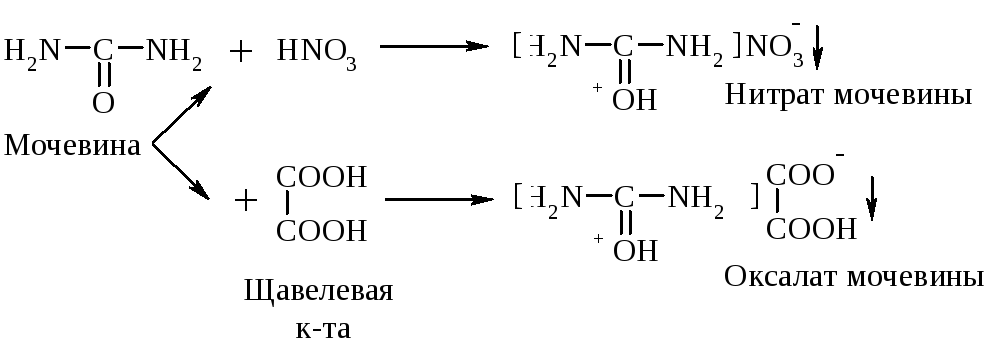
Оснóвным центром в мочевине считают атом О. Соли нитрат и оксалат мочевины – твердые вещ-ва, плохо растворимы в воде:
Химические св-ва
В химическом отношении мочевина проявляет св-ва аминов и амидов кислот.
Как амины она образует соли с минеральными и сильными органическими к-тами. Являясь слабым основанием (р, -сопряжение ослабляет оснóвные св-ва), она реагирует только с одним эквивалентом к-ты (р-ции см. выше). Р-ция образования нитрата мочевины используется в клинике для выделения мочевины из мочи.
Взаимодействие с НNO2
При действии НNО2 мочевина, как первичный амин, выделяет N2. Это находит применение для количественного определения мочевины по объему выделившегося азота:
(NH2)2CO + 2HONO 2N2 + CO2 + 3H2O
При действии алкилирующих средств получают алкилмочевину:
Н2N–![]() –NH2
+ С1 – СН3
Н2N–
–NH2
+ С1 – СН3
Н2N–![]() –NH–СН3
+ НС1
–NH–СН3
+ НС1
Хлорметан
Образование уреидов
При действии ацилирующих средств (RCO-C1) получают уреиды. Некоторые из них являются лекарственными препаратами.
Н
Ацетилхлорид![]() + Cl–CO–CH3
+ Cl–CO–CH3
![]() Н2N–CO–NH–
Н2N–CO–NH–![]() –CH3
–CH3
Ацетилмочевина
СН3–![]() –
–![]() –
–![]() –NHСОNH2
–NHСОNH2
Бромизовал (бромурал) – снотворное средство.
Важное значение имеет уреид мочевины и малоновой к-ты:

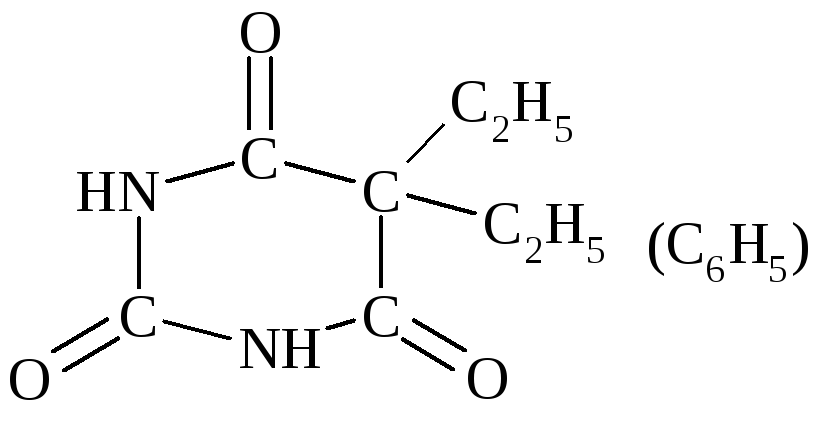
Производные барбитуровой к-ты обладают снотворным действием:
|
|
Диэтилбарбитуровая к-та – веронал, этилфенилбарбитуровая к-та – люминал. |
Гидролиз мочевины
Мочевина гидролизуется в присутствии к-т или щелочей. В организме гидролиз проходит под действием фермента уреазы:
(NH2)2CO + HOH CO2 + 2NH3
Образование биурета

Биурет с Сu(ОН)2 в щелочной среде образует комплексное соединение красно-фиолтового цвета. Эта качественная р-ция наз-ся биуретовой, она служит для обнаружения пептидов и белков.

Действие щелочного р-ра гипобромита натрия
Происходит выделение N2 и образование угольной к-ты (р-ция А. Гофмана и А. Бородина):
(NH2)2CO + 3NaBrO 3NaBr + N2 + CO2 + 2H2O
|
|
иминомочевина (гуанидин) входит в состав аминокислоты аргинина |
Н2N – СООН – карбаминовая к-та – неполный амид Н2СО3. В свободном состоянии не существует, однако соли (карбаматы) и эфиры (уретаны) этой к-ты достаточно устойчивы и находят практическое применение. Эфиры являются снотворными средствами.

30%-ный р-р мочевины + 10%-ный р-р глюкозы – средство для предупреждения и уменьшения отека мозга.
Контрольные вопросы к теме: «Карбоновые кислоты мочевина»
Какие соединения называются карбоновыми кислотами.
Номенклатура и изомерия карбоновых кислот.
Классификация карбоновых кислот.
На основе электронного строения карбоксильной группы дайте характеристику химическим свойствам кислот.
Какие кислоты называются 2-х основными. Приведите примеры.
Сравните по кислотным свойствам этановую и этандиовую кислоты. Какая из кислот проявляет более выраженные кислотные свойства и почему?
Напишите электронное строение молекулы мочевины.
Объясните на основе электронного строения молекулы мочевины основные химические свойства этого соединения.
Упражнения:
Напишите все изомеры общей формулы С4Н8О2. назовите их.
Изобразщите строение карбоксильной группы. Укажите основные реакционные центры карбоновых кислот.
Напишите реакции уксусной кислоты с Са, СаО, Са (ОН)2 и СаСО3.
Напишите реакции образования сложного эфира, ангидрида, хлорангидрида и амида уксусной кислоты.
Напишите изомеры бутен-2-диовой кислоты.
Получите а) кислую и среднюю соль щавелевой кислот, б) полный и неполный амид щавелевой кислоты.
Напишите реакции: а) декарбоксилирования малоновой кислоты, б) дегидратация янтарной кислоты, в) дегидратация малеиновой кислоты.
Сравните основные свойства мочевины и аминов.
Напишите реакции мочевины с: а) HCl, б) хлорангидридом уксусной кислоты, малоновой кислоты.
Напишите реакцию образования биурета и качественную реакцию на него.
Л и т е р а т у р а:
1. Тюкавкина С. 194-213, 247-252, 207-210.