
- •С.И. Кулиев
- •Часть 1
- •1.1. Цели и задачи дисциплины, её место в учебном процессе
- •1.2. Основные требования к знаниям и умениям
- •1.3. Межпредметные связи
- •1.4. Программа курса «Радиобиология» Введение
- •1. Физические основы радиобиологии
- •2. Основы радиоэкологии
- •3. Токсикология радионуклидов
- •4. Биологическое действие ионизирующих излучений
- •5. Гигиенические аспекты радиационной безопасности
- •6. Излучение как инструмент исследования
- •1.6. Распределение часов по семестрам и видам занятий
- •1.7. Тематический план лекций
- •1.8. Тематический план лабораторно- практических занятия, их содержание и объем в часах
- •1.9. Вопросы к лабораторно- практическим занятиям Занятие № 1 Радиоактивность. Взаимодействие различных видов ии с веществом
- •Занятие № 2 Токсикология радионуклидов Биологическое действие ии
- •Занятие № 3 Радиационные повреждения на различных уровнях организации Радиационная безопасность
- •1.10. Контрольные вопросы для подготовки к зачёту
- •1.11. Основная и дополнительная литература
- •Часть 2
- •Раздел 1 (лекции № 1–2) радиобиология как предмет. Физические основы радиобиологии
- •После изучения данного раздела Вы должны будете
- •Глава 1.1. Радиобиология как предмет
- •1.1.1. Радиобиология как предмет
- •Задачи радиобиологии:
- •1.1.2. История открытия радиации
- •1.1.3.Три этапа развития радиобиологии
- •Глава 1.2. Физико-химические основы радиобиологии
- •1.2.1. Характеристика атомного ядра
- •1.2.2. Ядерные силы, дефект массы
- •1.2.3. Типы ядерных превращений
- •1.2.4. Закон радиоактивного распада
- •1.2.5. Активность радиоактивного элемента
- •Основные физические величины, используемые в радиационной биологии
- •Глава 1.3. Природа ионизирующих излучений
- •1.3.1. Виды ии
- •Энергия квантов и длины волн различных природных излучений
- •1.3.2. Взаимодействие радиоактивных излучений с веществом
- •Раздел 2 (лекции № 3–4) основы радиоэкологии
- •Глава 2.1. Естественный и антропогенный радиационный фон
- •2.1.1. Космическое излучение, его природа, характеристики.
- •2.1.2. Естественный радиационный фон
- •Действие ионизирующего излучения на внешнюю среду
- •2.1.3. Радиоактивные элементы земных пород и пищи
- •Характеристики основных изотопов
- •2.1.4. Семейства радиоактивных элементов
- •Семья радионуклидов урана
- •2.1.5. Радиационные пояса Земли
- •Глава 2.2. Антропогенный радиационный фон
- •2.2.1. Искусственные источники ии
- •2.2.2. Деление и синтез ядер
- •2.2.3. Строительные материалы
- •Глава 2.3. Перемещения радиоактивных веществ в биосфере
- •2.3.1. Общие закономерности
- •2.3.2. Поведение радионуклидов в атмосфере
- •2.3.3. Поведение радионуклидов в почве
- •Классификация химических элементов по коэффициентам накопления
- •2.3.4. Поведение радионуклидов в воде
- •Глава 2.4. Экологические проблемы атомной промышленности
- •2.4.1. Радиоактивные отходы
- •Классификация жидких и твердых радиоактивных отходов по удельной радиоактивности
- •Классификация твердых радиоактивных отходов по уровню радиоактивного загрязнения
- •2.4.2. Возможности технических средств радиационной разведки (рдр)
- •Раздел 3 (лекции № 5–7) биологическое действие ионизирующего излучения на живые объекты
- •После изучения данного раздела Вы должны будете
- •Глава 3.1. Токсичность радионуклидов
- •3.1.1. Факторы, обуславливающие токсичность радионуклидов
- •Коэффициенты относительной биологической эффективности (обэ) для разных видов излучения
- •Типы распределения радиоактивных элементов в организме
- •3.1.2. Классификация радионуклидов по их токсичности для человека и животных
- •Глава 3.2. Накопление радионуклидов в органах и тканях
- •3.2.1. Особенности биологического действия инкорпорированных радионуклидов
- •3.2.2. Биологическое действие инкорпорированного j131
- •3.2.3. Биологические эффекты при внутреннем облучении i37Cs
- •3.2.4. Комбинированное действие инкорпорированных Cs137 и j131
- •Глава 3.3. Механизм биологического действия ии
- •3.3.1. Прямое и непрямое действие радиации
- •3.3.2. Свободнорадикальные процессы
- •3.3.3. Теории непрямого действия ии. Теория липидных радиотоксинов
- •Глава 3.4. Воздействие ии на различных уровнях
- •3.4.1. Этапы воздействия
- •3.4.2. Молекулярный уровень
- •3.4.3. Репарационные системы
- •3.4.4. Клеточный уровень
- •3.4.5. Восстановление после облучения на клеточном уровне
- •3.4.6. Радиочувствительность
- •Средняя летальная доза в рентгенах
- •3.4.7. Радиочувствительность клеток костного мозга и крови. Закон Бергонье-Трибондо
- •Глава 3.6. Радиочувствительность организмов и тканей
- •3.6.1. Радиочувствительность при внешнем облучении
- •3.6.2. Тканевая радиочувствительность
- •3.6.3. Механизмы радиоэмбриологического эффекта и оценка его последствий
- •3.6.4. Общие принципы функционирования самообновляющейся системы на примере костного мозга
- •Глава 3.7. Лучевая болезнь человека
- •3.7.1. Лучевая болезнь человека как биологический эффект
- •Шкала зависимости биологических эффектов при общем облучении организма
- •3.7.2. Олб при относительно равномерном облучении
- •3.7.3. Острые лучевые поражения при неравномерном поражении
- •Глава 3.9. Хроническая лучевая болезнь и влияние малых доз радиации
- •3.9.1. Хроническая лучевая болезнь
- •3.9.2. Действие малых доз радиации
- •Минимальная абсолютно летальная доза для различных видов
- •Принципиальные отличия между облучением в больших и малых дозах
- •3.9.3. Опосредованные эффекты облучения
- •Глава 3.10. Отдаленные последствия облучения
- •3.10.1. Формы и проявления отдалённых последствий
- •3.10.2. Механизм отдалённых последствий
- •Глава 3.11. Процессы восстановления в облучённом организме
- •3.11.1. Кинетика восстановления организма после тотального облучения
- •3.11.2. Фазное изменение радиорезистентности организма в раннем пострадиационном периоде
- •Раздел 4 (лекции № 8)
- •4.1.2. Планируемое повышенное облучение
- •Глава 4.3. Требования к ограничению облучения населения
- •4.3.1. Ограничение техногенного облучения в нормальных условиях
- •4.3.2. Ограничение медицинского облучения
- •4.3.3. Санитарные правила
- •Определение класса работ в лаборатории
- •Раздел 5 (лекция № 9) ионизирующее излучение на службе у человека
- •5.1. Циклотрон и его применение
- •5.2. Использование радиоактивных изотопов в качестве индикаторов (меченых атомов)
- •5.3. Датировака событий с помощью радиоуглерода
- •5.4. Радиобиология – Продовольственной программе
- •Оптимальные условия совместного использования облучения и умеренного нагрева для продления сроков хранения фруктовых соков
- •Продление сроков хранения свежей рыбы и морских продуктов при гамма-облучении
- •Учебное издание
- •Радиобиология Курс лекций
- •210038, Г. Витебск, Московский проспект, 33.
Глава 1.2. Физико-химические основы радиобиологии
1.2.1. Характеристика атомного ядра
Атом – мельчайшая частица вещества, являющаяся носителем его свойств. Молекула – мельчайшая частица сложного вещества состоит из атомов. Раньше считалось, что атом неделим. Позже выяснилось, что он является сложной системой. Атом любого элемента можно разделить на субатомные (элементарные) частицы (рис. 3). Атомы всех элементов, входящих в периодическую систему, состоят из электронов, протонов и нейтронов. Один элемент отличается от другого только числом и расположением этих частиц. В зависимости от уровня энергии, которая удерживает электроны вокруг ядра, они группируются на том или ином уровне. Электронные уровни (слои) создают оболочку атома. Количество электронов в каждом слое строго определено.

Рис. 3. Строение атома.
Электрон – устойчивая элементарная частица с массой покоя, равной 0,000548 а.е. м., или 9,1*10-28 г. Энергетический эквивалент электрона составляет 0,511 МэВ. Электрон несёт один элементарный отрицательный заряд. В атоме количество электронов всегда равно сумме протонов. В силу равенства положительных и отрицательных зарядов атом представляет собой электронейтральную систему. При сообщении электронам извне дополнительной энергии они могут переходить с одного энергетического уровня на другой или покидать пределы данного атома. Если воздействие будет слабее энергии связи электрона с ядром, то электрон перейдёт на вышележащий уровень. Такой атом останется нейтральным, но будет отличаться избытком энергии. Атомы, обладающие избытком энергии, называются возбуждёнными, а сам процесс перехода – возбуждением.
Поскольку в природе всякая система стремиться перейти в положение с минимумом энергии, то и атом из возбуждённого состояния переходит в нормальное, что сопровождается выделением избыточной энергии. Переход электронов с внешних орбит на внутренние сопровождается рентгеновским излучением с длиной волны, характерной для каждого энергетического уровня данного атома. Переходы в пределах внешних орбит дают оптический спектр, который состоит из ультрафиолетовых, световых и инфракрасных лучей. При сильных электрических воздействиях электроны вырываются из ядра и удаляются из него. Атом, лишившийся электронов, превращается в положительно заряженный ион, а присоединивший к себе электроны – в отрицательный. Процесс образования ионов называется ионизацией. Атом в состоянии иона существует непродолжительное время. Вакантное место заполняется свободным электроном и атом снова становиться электронейтральным. Этот процесс носит название рекомбинации ионов или деионизации и сопровождается выделением энергии.
Ядро атома состоит из двух типов частиц: протонов и нейтронов, которые имеют общее название нуклон (рис. 4.).
Р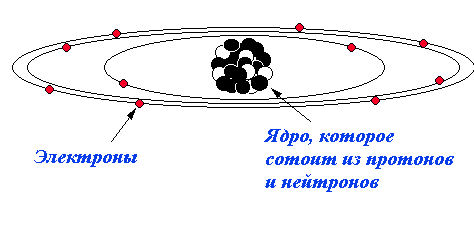 ис.
4. Строение атома.
ис.
4. Строение атома.
Протон – устойчивая элементарная частица, которая в 1840 раз тяжелее электрона, имеет положительный заряд, равный заряду электрона. Также протон часто определяют как ядро атома водорода. Количество протонов в ядре называется атомным номером или зарядовым числом (Z); оно соответствует порядковому номеру элемента периодической системе.
Нейтрон – электрически нейтральная частица, масса которой равна 1,00898 а. е. м. Сам по себе нейтрон нестабилен. Находясь в свободном состоянии, он испускает электрон и антинейтрино и превращается в протон. Нейтроны, находящиеся в ядре дают основном только физическую характеристику элемента, так как в разных ядрах одного и того же элемента может быть разное количество нейтронов (1-10). В ядрах лёгких устойчивых элементов число протонов и нейтронов относится друг к другу как 1:1. Чем дальше элемент в таблице Д.И. Менделеева, тем больше в его атомах число нейтронов по сравнению с протонами.
Диаметр ядра равен примерно 10–13–10–12 см, но практически вся масса сосредоточена в нём. Масса электронной оболочки незначительна, поэтому масса ядра совпадает с массой атома. Сумма протонов и нейтронов в ядре называется массовым числом и обозначается буквой А (или М). Число нейтронов N в ядре равно разности между массовым числом и атомным номером элемента N = A – Z.
При
обозначении атомов обычно используют
символ элемента, которому принадлежит
атом, и указывают слева вверху массовое
число, а внизу – порядковый номер в виде
индекса:
![]() .
Порядковый
номер иногда опускают.
.
Порядковый
номер иногда опускают.
Большинство химических элементов в природе представляет собой определённые смеси атомов с различным числом нейтронов в ядрах. Атомы, однотипные по количеству протонов (с одинаковым зарядом), но различные по количеству нейтронов, называются изотопами. Такие элементы имеют одинаковый порядковый номер, но разное массовое число (см. рис. 5). Большинство природных элементов представляет собой смесь из 2–10 изотопов.
А томы
элементов с одинаковым массовым числом,
но ядра которых находятся в различном
энергетическом состоянии, называютизомерами.
Они обладают разным периодом полураспада,
энергией и видом излучения. Про изомер
с избытком энергии говорят, что он
находиться в метастабильном состоянии.
Символически такое состояние обозначаю
латинской буквой «m», поставленной рядом
с массовым числом (80mBr).
Отдавая излишек энергии, метастабильный
изомер переходит в основное состояние.
томы
элементов с одинаковым массовым числом,
но ядра которых находятся в различном
энергетическом состоянии, называютизомерами.
Они обладают разным периодом полураспада,
энергией и видом излучения. Про изомер
с избытком энергии говорят, что он
находиться в метастабильном состоянии.
Символически такое состояние обозначаю
латинской буквой «m», поставленной рядом
с массовым числом (80mBr).
Отдавая излишек энергии, метастабильный
изомер переходит в основное состояние.
В природе существуют ядра разных элементов с одинаковым массовым числом, но разным атомным номером. Такие атомы называют изобарами (например, и ). Атомные ядра разных элементов с равным количеством нейтронов называют изотонами ( и ; в ядре первого 6 протонов и 7 нейтронов, а в ядре второго 7 протонов и тоже 7 нейтронов).
