
- •Глава 1. Основы теоретических представлений в органической химии
- •1.1. Учение а.М. Бутлерова
- •1.2. Теория гибридизации атомных орбиталей
- •1.3. Ковалентная связь
- •1.3.3. Водородные связи
- •1.4. Теория электронных смещений
- •1.5. Классификация и номенклатура органических соединений
- •1.5.1. Заместительная номенклатура
- •1.5.2. Радикало-функциональная номенклатура
- •1.5.4. Рациональная Номенклатура
- •1.6. Представление о Кислотно-оснÓвных свойствах органических соединений
- •1.7. Основы стереохимии
- •1.7.1. Оптическая изомерия
- •1.7.2. Геометрическая изомерия
- •1.7.3. Конформационная изомерия
- •1.8. Классификация органических реакций. Понятие о механизме реакций. Растворители и катализаторы
- •1.9. Методы идентификации органических соединений. Основные физические константы
- •1.10. Методы разделения и очистки органических веществ
- •1.10.1. Разделение твёрдых смесей и очистка твёрдых веществ
- •1.10.2. Разделение жидких смесей и очистка жидкостей
- •1.11. Представление о биологическом действии и метаболизме органических соединений
- •Вопросы и упражнения
1.2. Теория гибридизации атомных орбиталей
Известно, что в большинстве органических соединений атом углерода четырёхвалентен. Однако электронная конфигурация его внешнего электронного слоя — 2s22p2, и образование четырёх ковалентных связей возможно при переходе атома углерода в возбуждённое состояние. При этом происходит «распаривание» электронов на s-подуровне, и один из них переходит на близкую по энергии р-орбиталь:
С 2s22p2 + 400 кДж/моль С* 2s12p3
Четыре неспаренных электрона внешнего электронного слоя заселяют разные по энергии орбитали: один электрон находится на s- и три электрона — на р-орбиталях.
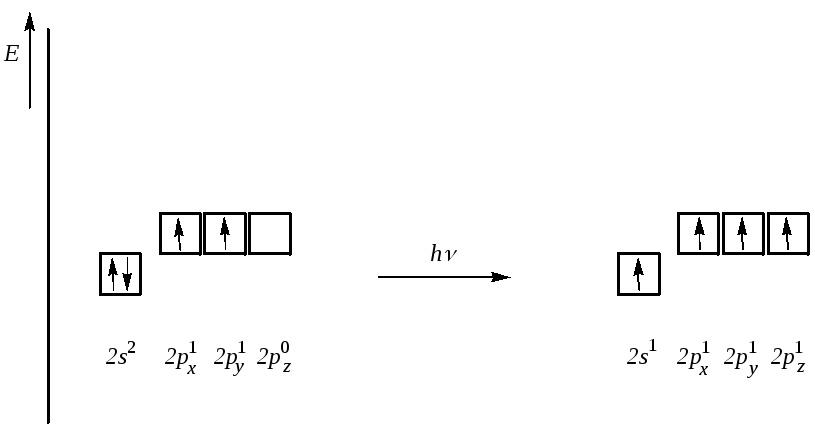
Из свойств соединений углерода известно, что если в молекуле атом углерода образует четыре ковалентные связи с четырьмя одинаковыми заместителями, то такие связи между собой абсолютно одинаковы. Например, в метане СН4 все четыре связи равноценны.
В 1931 году Л. Полинг* выдвинул гипотезу, согласно которой атомные орбитали углерода в возбуждённом состоянии как бы смешиваются, выравниваются по форме и энергии, то есть усредняются — гибридизуются.
Из одной s- и трёх р-орбиталей образуется четыре равноценных гибридных орбитали. Из четырёх разных орбиталей образуется четыре одинаковых по энергии и по форме атомных орбитали, при этом тип гибридизации здесь sp3, так как в гибридизации участие принимают одна s- и три р-орбитали. Для гибридизации, как и для возбуждения атома углерода, требуются затраты энергии.
одна s + три р четыре sp3

Это первое валентное состояние углерода.
Геометрическая форма sp3-гибридных орбиталей — вытянутые объёмные «восьмёрки», расположение в пространстве — на максимальном удалении друг от друга, то есть оси этих орбиталей должны быть направлены к вершинам правильного тетраэдра, и валентный угол (угол между осями орбиталей) соответствует такому пространственному их расположению и составляет 10928.
Этим можно объяснить способность атома углерода образовывать четыре равноценные ковалентные связи с четырьмя другими одинаковыми атомами (как, например, с атомами водорода в молекуле метана).
При смешении, гибридизации трёх орбиталей: одной s- и двух р-орбиталей образуются три равноценные гибридные орбитали sp2-типа:
одна s + две р три sp2.
Геометрическая форма и расположение в пространстве sp2-гибридных орбиталей — объёмные «восьмёрки». Эти орбитали — менее вытянутые, чем орбитали sp3-типа, так как доля p-орбиталей в гибридной орбитали здесь меньше, и sp2-гибридная орбиталь менее похожа на p-орбиталь, чем орбиталь sp3-типа. Оси их лежат в одной плоскости и направлены под углом 120 друг к другу.
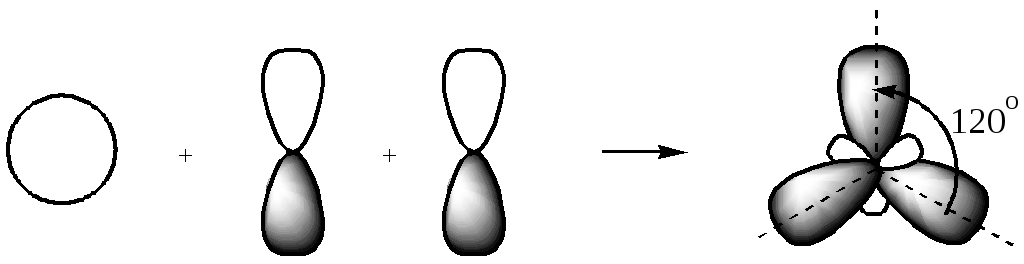
Это второе валентное состояние углерода.
В том случае, когда гибридизации подвергаются одна s- и одна р-орбиталь, образуются две sp-гибридные орбитали:
одна s + одна р две sp ,
оси которых находятся под углом 180, то есть лежат на одной прямой. Это ещё менее вытянутые орбитали, чем sp2-гибридные.

Это третье валентное состояние углерода.
Характеристика валентного состояния углерода и образуемых им связей приведена в табл. 1.1.
Таблица 1.1
Характеристика углерод-углеродных связей в молекулах этана, этилена и ацетилена
|
Соединение |
Гибридизация |
Вклад s-орбитали, % |
Относ. электроотр. атома С |
Характеристика связи | |||
|
Связь |
Длина, нм |
Энергия, кДж/моль |
Энергия на одну связь, кДж/моль | ||||
|
СН3–СН3 |
sp3 |
25.0 |
2.50 |
С–С |
0.154 |
348 |
348 |
|
СН2=СН2 |
sp2 |
33.3 |
2.76 |
С=С |
0.134 |
607 |
304 |
|
СНСН |
sp |
50.0 |
3.20 |
СС |
0.120 |
829 |
276 |
Н о
данные типы гибридизации характерны
лишь для небольшого числа соединений.
Для соединений с неодинаковыми
заместителями у атома углерода имеются
отклонения от классической схемы. В
пропанеСН3-СН2-СН3,
например, из-за того, что центральный
атом углерода образует две С–С-
и две С–Н-связи,
орбитали, участвующие в образовании
этих связей, будут по-разному отталкиваться
и валентные углы искажаются: НСН
= 107;
ССС
= 112.
В данном случае говорится о нестрогой
гибридизации.
о
данные типы гибридизации характерны
лишь для небольшого числа соединений.
Для соединений с неодинаковыми
заместителями у атома углерода имеются
отклонения от классической схемы. В
пропанеСН3-СН2-СН3,
например, из-за того, что центральный
атом углерода образует две С–С-
и две С–Н-связи,
орбитали, участвующие в образовании
этих связей, будут по-разному отталкиваться
и валентные углы искажаются: НСН
= 107;
ССС
= 112.
В данном случае говорится о нестрогой
гибридизации.
По Полингу, степень гибридизации атомных орбиталей связана с валентным углом уравнением:
1 + ijcosij = 0 или 1 + 2cos = 0 ,
где i(j) — коэффициент смешения орбиталей, а 2 — степень гибридизации (здесь количество р-орбиталей, принимающих участие в гибридизации с одной s-орбиталью); ij — валентный угол (угол между i-ной и j-ной атомными орбиталями). Например,
для sp-гибридных орбиталей 2 = 1, cos = –1, = 180; для sp2-гибридных — 2 = 2, cos = –1/2, = 120; для sp3-гибридных — 2 = 3, cos = –1/3, = 109.47 (или 10928).
Но в общем случае степень гибридизации может быть и дробной, так как валентные углы между разными связями в различных соединениях могут сильно отличаться от приведенных выше. В этих случаях необходимо помнить, что степень гибридизации — это лишь формальное число р-орбиталей, приходящихся в гибридизации на одну s-орбиталь.
