- •Глава 1. Основы теоретических представлений в органической химии
- •1.1. Учение а.М. Бутлерова
- •1.2. Теория гибридизации атомных орбиталей
- •1.3. Ковалентная связь
- •1.3.3. Водородные связи
- •1.4. Теория электронных смещений
- •1.5. Классификация и номенклатура органических соединений
- •1.5.1. Заместительная номенклатура
- •1.5.2. Радикало-функциональная номенклатура
- •1.5.4. Рациональная Номенклатура
- •1.6. Представление о Кислотно-оснÓвных свойствах органических соединений
- •1.7. Основы стереохимии
- •1.7.1. Оптическая изомерия
- •1.7.2. Геометрическая изомерия
- •1.7.3. Конформационная изомерия
- •1.8. Классификация органических реакций. Понятие о механизме реакций. Растворители и катализаторы
- •1.9. Методы идентификации органических соединений. Основные физические константы
- •1.10. Методы разделения и очистки органических веществ
- •1.10.1. Разделение твёрдых смесей и очистка твёрдых веществ
- •1.10.2. Разделение жидких смесей и очистка жидкостей
- •1.11. Представление о биологическом действии и метаболизме органических соединений
- •Вопросы и упражнения
1.7.2. Геометрическая изомерия
Геометрическая изомерия — разновидность стереоизомерии, которая определяется различием пространственного расположения в молекулах пары заместителей относительно плоскости двойной связи или цикла. Геометрическая изомерия возможна только в том случае, когда каждый из атомов углерода, образующих двойную связь (или цикл), имеет разные между собой заместители. Так, в структуре бутена-2 у каждого из двух атомов углерода двойной связи разные заместители (СН3 и Н):
СН3-СН=СН-СН3
Геометрическая изомерия ещё называется цис-транс-изомерией. В наиболее простых случаях цис-изомером является соединение, в котором оба атома водорода располагаются по одну сторону плоскости двойной связи, а транс-изомером — соединение с расположением атомов водорода по разные стороны двойной связи. Например, для стереоизомеров бутена-2

цис-бутен-2 транс-бутен-2
Однако в общем случае, например,
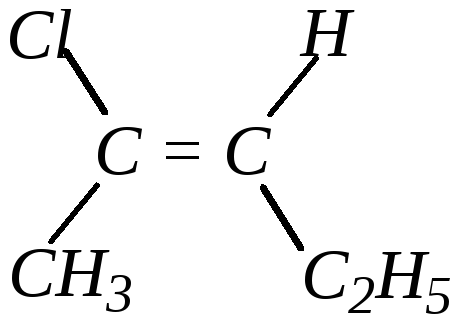 ,
,
для того, чтобы определить, является ли данное соединение цис- или транс-изомером, необходимо использовать систему старшинства заместителей Кана–Ингольда–Прелога (см. оптическую изомерию — гл. 1.7.1). Если старшие заместители расположены по разные стороны плоскости двойной связи, то это — транс-изомер или конфигурацию называют Е (Entgegen — напротив), а если по одну сторону — цис-изомер или Z-конфигурация (Zusammen — вместе). В приведённом примере изображён транс-изомер (транс-2-хлорпентен-2 или Е-2-хлорпентен-2), так как старшими заместителями являются заместители Cl (старше, чем СН3) и С2Н5 (старше, чем Н).
В молекулах геометрических изомеров атомы по-разному расположены в пространстве относительно друг друга. Этим обусловлены различия их физических и химических свойств.
1.7.3. Конформационная изомерия
В молекулах отдельные структурные элементы (атомы и атомные группировки) совершают вращательные и колебательные движения относительно друг друга, в том числе возможно свободное вращение вокруг углерод-углеродных -связей. Таким образом, молекулы алканов могут иметь множество положений атомов в пространстве, что является следствием такого вращения. Конформационная изомерия как вид стереоизомерии связана с различным пространственным расположением атомов в молекуле, обусловленным таким вращением. Поэтому конформационная изомерия характерна для всех органических соединений (за исключением наиболее простых), в том числе и для насыщенных углеводородов, начиная с этана C2Н6.
Различные положения атомов и атомных группировок в пространстве, возникающие в результате их вращения вокруг -связей, называются конформациями данной молекулы. Те состояния, которые отвечают минимумам (а иногда считается, и максимумам) на энергетической диаграмме, именуются конформационными изомерами или конформерами. Их взаимные переходы обозначаются как конформационные переходы. В реальности жидкие и газообразные вещества существуют в виде смесей конформеров, среди которых преобладают энергетически более выгодные.
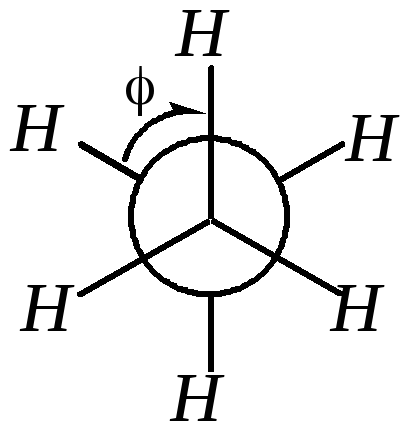
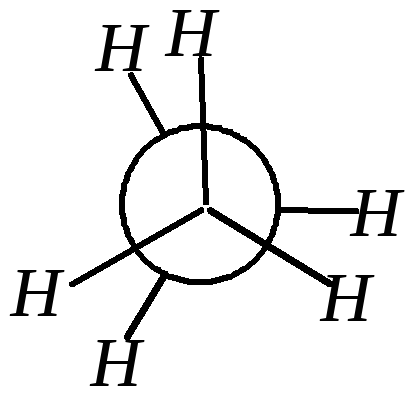
Для лучшего рассмотрения этих конформаций модели молекул проецируются на плоскость (проекции Ньюмена*). На рисунке наблюдатель смотрит вдоль оси связи C–C (относительно которой рассматриваются конформации) и видит, что один атом углерода находится за другим. Ближайший к наблюдателю атом углерода изображают точкой; от него идут три связи к трём другим атомам. Более удаленный атом углерода изображают в виде круга; принадлежащие ему заместители как бы «высовываются» из-за круга.
Рассмотрим внутримолекулярное вращение этана H3C–CH3 вокруг связи C–C. В этом процессе одна из метильных групп молекулы может занимать относительно другой метильной группы множество положений, из которых два (А и В)
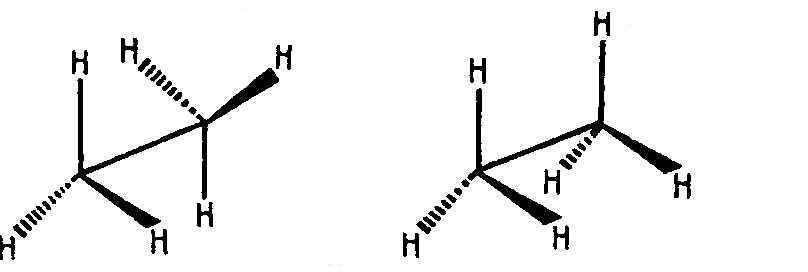
(А) (В)
представляют особый интерес. Изобразим их проекционными формулами Ньюмена:
|
|
|
|
(А) |
(В) |
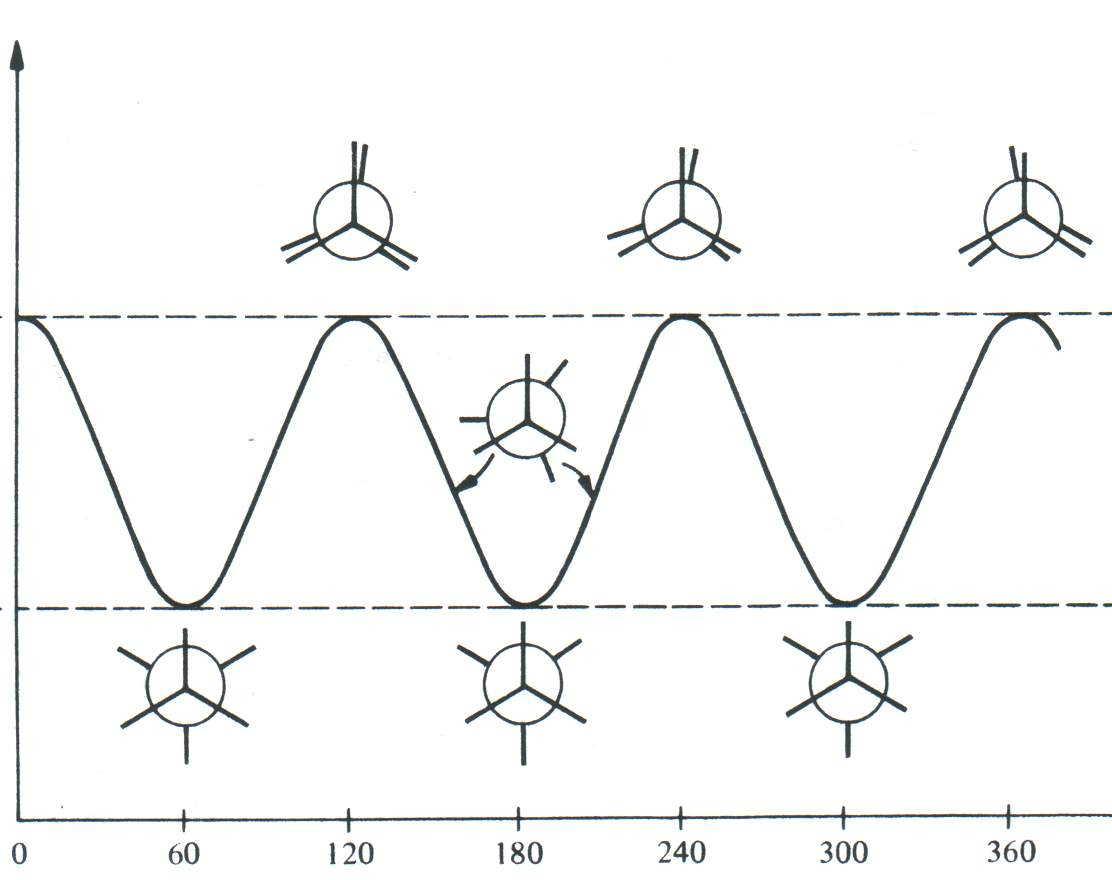
Угол поворота одной атомной группировки относительно другой обозначается и называется торсионным углом. При значениях = 0° (360°), 120° и 240° (–120°) атомы водорода находятся один за другим (максимально сближены в пространстве). Такую конформацию (В) называют заслонённой. За счёт ван-дер-ваальсового отталкивания атомов и отталкивания спаренных электронов химической связи эта конформация обладает максимальной конформационной энергией (наименее стабильна). При значениях = 60°, 180° и 300° (–60°) атомы водорода максимально удалены один от другого. Эта конформация (А), которую называют заторможенной, скошенной или гош-конформацией, обладает минимальной конформационной энергией (наиболее стабильна). В случае этана три энергетические ямы при заторможенной конформации и три энергетических барьера при заслонённой конформации одинаковы.
Между двумя экстремальными случаями существуют промежуточные конформации. Вращение от устойчивой и до неустойчивой конформации требует определённой энергии. Величина энергетического барьера, затрудняющего превращение заторможенного конформера в заслонённый, называется поворотной или торсионной энергией, или торсионным напряжением. Для этана эта энергия составляет 12 кДж/моль, что при обычных условиях соответствует частоте перехода из одной гош-конформации в другую, равной 1010 с-1 (каждую секунду происходит 1010 переходов). В то же время на 10 000 молекул этана, обладающих заторможенной конформацией, приходится лишь одна, обладающая заслонённой конформацией. Энергетическая диаграмма внутримолекулярного вращения этана изображена на рисунке 1.1.
|
Энергия |
|
Рис. 1.1. Энергетическая диаграмма внутримолекулярного вращения этана
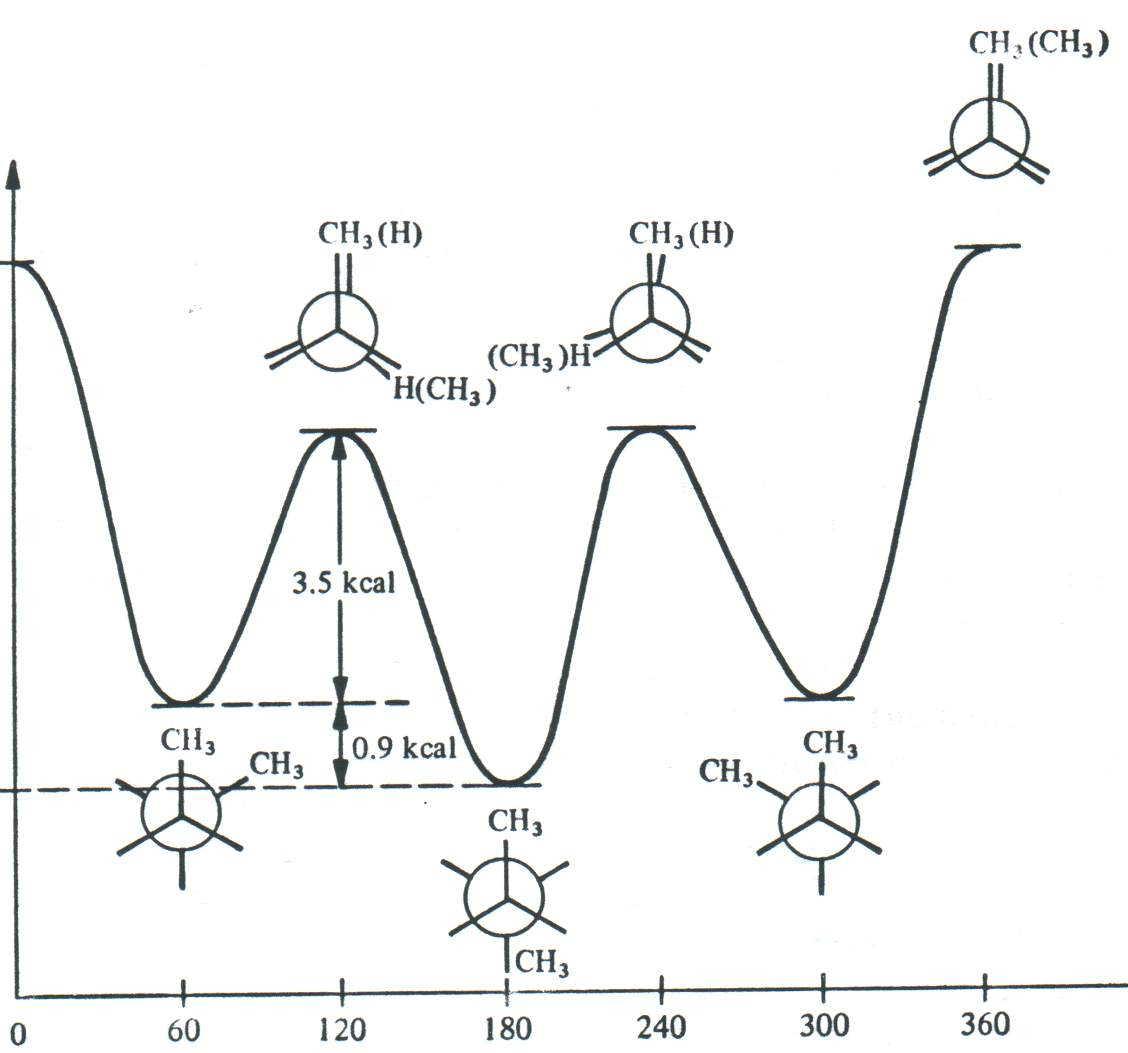
Сложнее обстоит дело с соединениями типа RCH2-CH2R. Рассмотрим конформации бутана (R = CH3), возникающие при его внутримолекулярном вращении относительно центральной C–C связи (рис.1.2).
|
Энергия |
|
Рис.1.2. Энергетическая диаграмма внутримолекулярного вращения бутана относительно связи С2–С3
Зависимость конформационной энергии от торсионного угла 1,2-дизамещённых этанов в принципе схожа с энергетической кривой незамещённого этана. Однако глубина энергетических ям и высота энергетических барьеров в этом случае различны. Самый глубокий минимум принято называть глобальным, остальные — локальными. Свободному вращению вокруг -связи препятствуют громоздкие заместители у атомов углерода. Таким образом, барьеры вращения для поворота вокруг связи C2–C3 в н-бутане больше, чем в этане. Несмотря на этот энергетический барьер, конформеры н-бутана не могут быть разделены.
В общих чертах величина энергетического барьера должна быть около 80—100 кДж/моль, чтобы предотвратить быстрое взаимное превращение и выделить конформеры при комнатной температуре.
При удлинении молекулы (увеличении числа связей, вокруг которых возможно вращение) число конформеров растет в геометрической прогрессии. С другой стороны, замыкание цепи в цикл накладывает ограничения на вращение вокруг связей. Атомы уже не могут совершать полный оборот 360°, что приводит к резкому уменьшению числа возможных конформеров.