- •Глава 1. Основы теоретических представлений в органической химии
- •1.1. Учение а.М. Бутлерова
- •1.2. Теория гибридизации атомных орбиталей
- •1.3. Ковалентная связь
- •1.3.3. Водородные связи
- •1.4. Теория электронных смещений
- •1.5. Классификация и номенклатура органических соединений
- •1.5.1. Заместительная номенклатура
- •1.5.2. Радикало-функциональная номенклатура
- •1.5.4. Рациональная Номенклатура
- •1.6. Представление о Кислотно-оснÓвных свойствах органических соединений
- •1.7. Основы стереохимии
- •1.7.1. Оптическая изомерия
- •1.7.2. Геометрическая изомерия
- •1.7.3. Конформационная изомерия
- •1.8. Классификация органических реакций. Понятие о механизме реакций. Растворители и катализаторы
- •1.9. Методы идентификации органических соединений. Основные физические константы
- •1.10. Методы разделения и очистки органических веществ
- •1.10.1. Разделение твёрдых смесей и очистка твёрдых веществ
- •1.10.2. Разделение жидких смесей и очистка жидкостей
- •1.11. Представление о биологическом действии и метаболизме органических соединений
- •Глава 2. Алканы
- •2.1. Номенклатура. Изомерия
- •2.2. Строение
- •2.3. Физические свойства
- •2.4. Химические свойства
- •2.4.1. Реакции радикального замещения
- •2.4.2. Реакции дегидрирования и разложения
- •2.4.3. Реакции изомеризации
- •Способы получения и природные источники
- •2.6. Применение и физиологическая роль
- •Глава 3. Функциональные производные алканов
- •3.1. ОбщноСть Химических свойств
- •3.1.1. Реакции нуклеофильного замещения
- •3.1.2. Реакции отщепления (элиминирования)
- •3.2. Галогеналканы
- •3.2.1. Классификация, номенклатура, изомерия
- •3.2.2. Строение и свойства
- •3.2.3. Способы получения
- •3.2.4. Полигалогеналканы
- •3.2.5. Физиологическая роль и Важнейшие представители
- •3.3. Насыщенные спирты
- •3.3.1. Классификация, номенклатура, изомерия
- •3.3.2. Строение и физические свойства
- •3.3.3. Химические свойства
- •3.3.4. Способы получения
- •3.3.5. Многоатомные спирты
- •3.3.6. Физиологическое действие
- •3.3.7. Важнейшие представители
- •3.4. Простые насыщенные эфиры
- •3.4.1. Номенклатура и изомерия
- •3.4.2. Физические и химические свойства
- •3.4.3. Способы получения
- •3.4.4. Циклические простые эфиры
- •3.4.5. Физиологическая роль и Важнейшие представители
- •3.5. Эфиры минеральных кислот
- •3.5.1. Эфиры серной кислоты
- •3.5.2. Эфиры фосфорной кислоты
- •3.6. Тиоспирты и тиоэфиры
- •3.7. Насыщенные амины
- •3.7.1. Классификация, номенклатура, изомерия
- •3.7.2. Физические свойства
- •3.7.3. Строение и химические свойства
- •3.7.4. Способы получения
- •3.7.5. Физиологическая роль и Важнейшие представители
- •3.8. Нитроалканы
- •3.8.1. Строение
- •3.8.2. Свойства
- •3.8.3. Способы получения
- •3.8.4. Физиологическое действие и Важнейшие представители
- •3.9. Кремний-, фосфор- и мышьякорганические соединения
- •3.9.1. Кремнийорганические соединения
- •3.9.2. Фосфорорганические соединения
- •3.9.3. Мышьякорганические соединения
- •Глава 4. Непредельные углеводороды
- •4.1. ОБщность строения и химических свойств
- •4.1.1. Реакции электрофильного присоединения
- •4.1.2. Реакции радикального присоединения
- •4.1.3. Реакции радикального замещения
- •4.1.4. Другие реакции
- •4.2. Этиленовые углеводороды
- •4.2.1. Номенклатура, изомерия
- •4.2.2. Физические свойства
- •4.2.3. Химические свойства
- •4.2.4. Способы получения
- •4.2.5. Физиологическое действие и Важнейшие представители
- •4.3. Диеновые (и полиеновые) углеводороды
- •4.3.1. Классификация, номенклатура
- •4.3.5. Способы получения
- •4.3.6. Важнейшие представители
- •4.4. Ацетиленовые углеводороды
- •4.4.1. Номенклатура, изомерия
- •4.4.2. Особенности строения и свойств
- •4.4.3. Способы получения
- •4.4.4. Физиологическое действие и Важнейшие представители
- •Глава 5. Функциональные производные непредельнЫх углеводороДов
- •5.1. ОБщность строения и химических свойств
- •5.1.1. Классификация
- •5.1.2. Субстраты винильного типа
- •5.1.3. Субстраты аллильного типа
- •5.2. Галогеналкены
- •5.2.1. Винилгалогениды
- •5.2.2. Аллилгалогениды
- •5.2.3. Способы получения
- •5.2.4. Важнейшие представители
- •5.3. Непредельные спирты и эфиры
- •5.3.1. Виниловый спирт и его эфиры
- •5.3.2. Аллиловый и пропаргиловый спирты
- •5.3.3. Способы получения
- •5.3.4. Важнейшие представители
- •Глава 6. Алифатические альдегиды, кетоны и карбоновые кислоты
- •6.1. Насыщенные альдегиды и кетоны
- •6.1.1. Изомерия, номенклатура
- •6.1.2. Строение карбонильной группы
- •6.1.3. Физические свойства
- •6.1.4. Химические свойства
- •6.1.5. Способы получения
- •6.1.6. Физиологическая роль
- •6.1.7. Важнейшие представители
- •6.2. Непредельные альдегиды и кетоны
- •6.2.1. Кетен
- •6.2.2. Непредельные карбонильные соединения
- •Примерами соединений с сопряжёнными -связями являются
- •6.2.3. Важнейшие представители
- •6.3. Дикарбонильные соединения
- •6.3.3. Важнейшие представители
- •6.4. Насыщенные монокарбоновые кислоты и их производные
- •6.4.1. Номенклатура
- •6.4.2. Строение функциональной группы
- •6.4.3. Физические свойства
- •6.4.4. Химические свойства
- •6.4.5. Способы получения
- •6.4.6. Пероксикарбоновые кислоты и ацилпероксиды
- •6.4.7. Физиологическая роль и Важнейшие представители
- •6.5. Непредельные монокарбоновые кислоты
- •6.5.1. Номенклатура, изомерия
- •6.5.2. Строение
- •6.5.3. Химические свойства
- •6.5.4. Способы получения
- •6.5.5. Физиологическая роль и Важнейшие представители
- •6.5.6. Омыляемые липиды
- •6.6. Дикарбоновые кислоты и их производные
- •6.6.1. Особенности химического поведения
- •6.6.2. Малоновый эфир и синтезы на его основе
- •2 H5c2ooc-ch2-cooc2h5
- •2 H5c2ooc-ch2-cooc2h5
- •6.6.3. Способы получения
- •2 Rooc-(ch2)n-сoo¯ 2 rooc-(ch2)n-сoo rooc-(ch2)2n-coor hooc-(ch2)2n-cooh
- •6.6.4. Важнейшие представители
- •6.7. Гидроксикислоты
- •6.7.1. Классификация, номенклатура, изомерия
- •6.7.2. Химические свойства
- •6.7.3. Способы получения
- •6.7.4. Физиологическая роль и Важнейшие представители
- •6.8. Оксокислоты
- •6.8.1. Особенности химического поведения
- •6.8.2. Ацетоуксусный эфир и синтезы на его основе
- •6.8.3. Способы получения
- •6.8.4. Важнейшие представители
- •6.9. Аминокарбоновые кислоты. Пептиды
- •6.9.1. Классификация, номенклатура, изомерия аминокислот
- •6.9.2. Строение, физические и Химические свойства
- •6.9.3. Способы получения аминокислот
- •6.9.4. Важнейшие представители аминокислот
- •6.9.5. Пептиды
- •Глава 7. Углеводы
- •7.1. Моносахариды
- •7.1.1. Изомерия, номенклатура
- •7.1.2. Химические свойства
- •7.1.3. Важнейшие представители моносахаридов и их производных
- •7.2. Олигосахариды
- •7.2.1. Классификация и номенклатура дисахаридов
- •7.2.2. Химические свойства дисахаридов
- •7.2.3. Важнейшие представители дисахаридов
- •7.3. Полисахариды
- •7.3.1. Целлюлоза
- •7.3.2. Амилоза и амилопектин
- •7.3.3. Гликоген
- •7.3.4. Декстраны
- •7.3.5. Хитин
- •7.3.6. Пектовая кислота
- •7.3.7. Гетерополисахариды
- •Глава 8. Алициклические углеводороды и их производные
- •8.1. Номенклатура моно- и бициклических соединений
- •8.2. Пространственное строение и изомерия циклоалканов
- •8.2.1. Циклопропан
- •8.2.2. Циклобутан
- •8.2.3. Циклопентан
- •8.2.4. Циклогексан
- •8.3. Химические свойства
- •8.3.1. Реакции циклопропана, циклопропена и их производных
- •8.3.2. Реакции циклобутана и его производных
- •8.3.3. Реакции средних циклов
- •8.3.4. Реакции изомеризации цикла
- •8.4. Способы получения циклоалканов
- •8.5. Терпены и терпеноиды. Каротиноиды
- •8.5.1. Ациклические терпены и терпеноиды
- •8.5.2. Моноциклические терпены и терпеноиды
- •8.5.3. Бициклические терпены и терпеноиды
- •8.5.4. Каротиноиды
- •8.6. Физиологическая роль и важнейшие представители
- •8.7. Стероиды
- •Глава 9. Бензол. Ароматичность. Углеводороды ряда бензола
- •9.1. Строение бензола
- •Тепловой эффект реакции гидрирования бензола составляет
- •9.2. Номенклатура и изомерия аренов
- •9.3. Строение аренов
- •9.3.1. Строение толуола
- •9.3.2. Строение винилбензола
- •9.4. Физические свойства
- •9.5. Химические Свойства
- •9.5.1. Химические свойства бензола
- •9.5.2. Химические свойства аренов
- •9.6. Способы получения
- •9.7. Физиологическое действие и важнейшие представители аренов
- •9.8. Небензоидные ароматические системы
- •Глава 10. Функциональные производные углеводородов ряда бензола
- •10.1. Общность строения и свойств монозамещённых бензолов
- •10.1.1. Электронные эффекты заместителей
- •10.1.2. Реакции электрофильного замещения
- •10.1.3. Реакции нуклеофильного замещения
- •10.2. Галогенарены
- •10.2.1. Классификация, номенклатура
- •10.2.2. Строение арилгалогенидов
- •10.2.3. Физические свойства
- •10.2.4. Химические свойства
- •10.2.5. Способы получения
- •10.2.6. Важнейшие представители
- •10.3. Ароматические сульфокислоты
- •10.3.1. Номенклатура
- •10.3.2. Строение
- •10.3.3. Физические и химические свойства
- •10.3.4. Способы получения
- •10.3.5. Производные сульфокислот
- •10.3.6. Медико-биологическое значение и Важнейшие представители
- •10.4. Ароматические нитросоединения
- •10.4.1. Строение нитробензола
- •10.4.2. Физические свойства
- •10.4.3. Химические свойства
- •10.4.4. Способы получения
- •10.4.5. Физиологическое действие и Важнейшие представители
- •10.5. Фенолы. Ароматические спирты. Хиноны
- •10.5.1. Классификация, номенклатура, изомерия фенолов и ароматических спиртов
- •10.5.2. Строение фенола и бензилового спирта
- •Ароматические амины и продукты неполного восстановления нитросоединений
- •10.6.1. Классификация, номенклатура, изомерия ароматических аминов
- •10.6.2. Строение анилина
- •10.6.3. Физические и химические свойства ароматических аминов
- •10.6.4. Способы получения ароматических аминов
- •10.6.5. Важнейшие представители ароматических аминов
- •10.6.6. Продукты неполного восстановления нитросоединений
- •10.7. Ароматические диазосоединения
- •10.7.2. Механизм образования солей арендиазония и строение катиона бензолдиазония
- •10.7.3. Амфотерность диазосоединений
- •10.7.4. Реакции солей арендиазония
- •10.8. Ароматические альдегиды и кетоны
- •10.9. Ароматические карбоновые кислоты и их производные
- •10.10. Физиологическая роль функциональных производных бензола
- •Глава 11. Полициклические ароматические углеводороды и их производные
- •11.1. Классификация углеводородов с конденсированными циклами
- •11.2. Нафталин
- •11.2.1. Строение, изомерия, номенклатура
- •11.2.2. Свойства
- •11.2.3. Способы получения
- •11.2.4. Важнейшие представители
- •11.3. Антрацен
- •11.3.1. Строение, изомерия, номенклатура
- •11.3.2. Свойства
- •Продукт исчерпывающего гидрирования (пергидроантрацен) можно получить, проводя реакцию в жёстких условиях с применением металлических катализаторов.
- •11.3.3. Способы получения
- •11.3.4. Важнейшие представители
- •11.4. Фенантрен
- •11.4.1. Строение, изомерия, номенклатура
- •11.4.2. Свойства
- •11.4.3. Способы получения
- •11.5. Физиологическое действие полициклических углеводородов
- •Глава 12. Гетероциклические соединения
- •12.1. Классификация и номенклатура
- •12.2. Пятичленные гетероциклические
- •12.2.1. Номенклатура пиррола, фурана и тиофена и их производных
- •12.2.2. Строение пиррола, фурана и тиофена
- •12.2.3. Физические и химические свойства пиррола, фурана и тиофена
- •12.2.4. Особенности индола
- •12.2.5. Способы получения пиррола, фурана, тиофена, индола
- •12.2.6. Важнейшие представители и медико-биологическое значение
- •12.3. Пятичленные гетероциклические
- •12.3.1. Номенклатура имидазола и пиразола
- •12.3.2. Строение имидазола и пиразола
- •12.3.3. Физические и химические свойства имидазола и пиразола
- •12.3.4. Способы получения
- •12.3.5. Важнейшие представители и медико-биологическое значение
- •12.4. Шестичленные гетероциклические
- •12.4.1. Номенклатура пиридина и его производных
- •12.4.2. Строение пиридина
- •12.4.3. Химические свойства пиридина
- •Но если оба -положения заняты, то замещается водород в-положении. При нагревании с избытком амида натрия можно получить 2,6-диаминопиридин.
- •12.4.4. Особенности химического поведения пиколинов и функциональных производных пиридина
- •12.4.5. Хинолин и изохинолин
- •12.4.7. Способы получения
- •Реакция аналогична получению бензола, протекает при высоких температурах, но представляет только теоретический интерес.
- •12.4.8. Важнейшие представители и медико-биологическое значение
- •12.5. Шестичленные гетероциклические
- •12.5.1. Строение и свойства диазинов
- •12.5.2. Пурин
- •12.5.3. Способы получения
- •12.5.4. Важнейшие представители и медико-биологическое значение
- •12.5.5. Нуклеозиды, нуклеотиды и нуклеиновые кислоты
- •12.6. Алкалоиды
Глава 7. Углеводы
Углеводы (или старое название сахарá) можно определить как полигидроксикарбонильные соединения и их производные природного происхождения. Название «углеводы» этим природным веществам было предложено в 1844 г. К. Шмидтом*, так как состав этих известных в то время соединений соответствовал формуле Сn(H2O)m.
Углеводы широко распространены в животном и растительном мире, они играют важную роль во многих жизненных процессах: и как источники энергии, и как структурные компоненты клеточных стенок растений и таких биологически важных веществ, как нуклеиновые кислоты. Углеводы составляют 80% от сухой массы растений и 2% от сухой массы животных организмов.
Все углеводы можно разделить на три группы: 1) моносахариды, 2) олигосахариды и 3) полисахариды. При этом моносахариды относят к простым углеводам, а олигосахариды и полисахариды к сложным.
7.1. Моносахариды
Моносахариды (или монозы) это полигидроксикарбонильные соединения и их производные с непрерывной углеродной цепью. Их молекулы содержат обычно одну карбонильную группу и несколько гидроксильных. Молекулы моносахаридов хиральны, содержат несколько асимметрических атомов углерода. Это определяет существование большого числа оптических изомеров.
В зависимости от характера карбонильной группы моносахариды подразделяют на 1) альдозы соединения, содержащие альдегидную группу, и 2) кетозы соединения, в состав которых входит кетонная группа. Например:

альдоза кетоза
В зависимости от количества атомов углерода в молекуле (от 3 до 10) моносахариды подразделяют на триозы, тетрозы, пентозы, гексозы, гептозы и т. д. Например:
тетроза пентоза гексоза
Таким образом, с учётом классификации по одному и по другому признакам возможны следующие группы моносахаридов: альдотетрозы, альдопентозы, альдогексозы, кетопентозы, кетогексозы и т.д.
Кроме собственно моносахаридов, молекулы которых не содержат других функциональных групп, кроме карбонильной и гидроксильных, и называемых нейтральными сахарами, существуют производные моносахаридов. Наиболее распространёнными среди них являются аминосахара (или, правильнее, аминодезоксисахара), в молекулах которых вместо одной или нескольких гидроксогрупп присутствуют аминогруппы, и кислые сахара, содержащие карбоксильные группы в составе своих молекул.
7.1.1. Изомерия, номенклатура
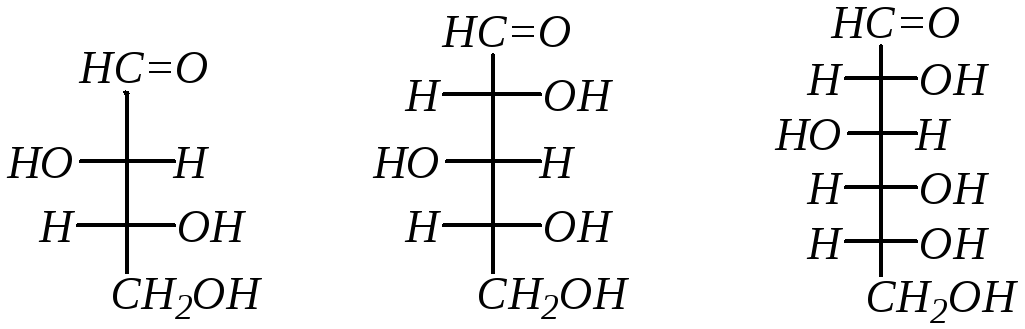
Как уже было замечено, молекулы моносахаридов содержат асимметрические атомы углерода, с чем связано существование нескольких оптических изомеров. Так, в молекуле единственной альдотриозы – глицеринового альдегида (гл. 1.7.1) один хиральный атом углерода, поэтому возможны только два энантиомера.
Разных изомерных альдотетроз в соответствии с числом хиральных центров возможно уже четыре. Относительная конфигурация моносахаридов определяется по конфигурационному стандарту – глицериновому альдегиду. С конфигурацией его хирального центра сравнивается конфигурация наиболее удалённого от карбонильной группы хирального атома углерода. Каждой альдозе D-ряда соответствует энантиомер (веществоL-ряда) с противоположной конфигурациейвсехцентров хиральности. У диастереомеров в принятой номенклатуре углеводов будут другие тривиальные названия, причём суффикс с окончанием -оза является общим и используется для названий всех моносахаридов:

D-эритроза L-эритроза D-треоза L-треоза
Изомерные альдопентозы могут быть представлены следующими формулами Фишера:

D-рибоза L-рибоза D-ксилоза L-ксилоза

D-арабиноза L-арабиноза D-ликсоза L-ликсоза,
а изомерных альдогексоз будет ещё в 2 раза больше (здесь приведены только соединения D-стереохимического ряда):

D-аллоза D-альтроза D-глюкоза D-манноза

D-гулоза D-идоза D-галактоза D-талоза
Из кетоз наиболее широко распространены фруктоза и сорбоза:

D-фруктоза L-фруктоза D-сорбоза L-сорбоза
Диастереомеры, различающиеся конфигурацией только одного асимметрического атома углерода, называются эпимерами. Эпимеры частный случай диастереомеров. Например, эпимерами являются D-рибоза и D-ксилоза, отличающиеся друг от друга только конфигурацией атома С3, а также D-глюкоза и D-манноза, различающиеся конфигурацией атома С2, и D-глюкоза и D-галактоза, различающиеся конфигурацией атома С4.
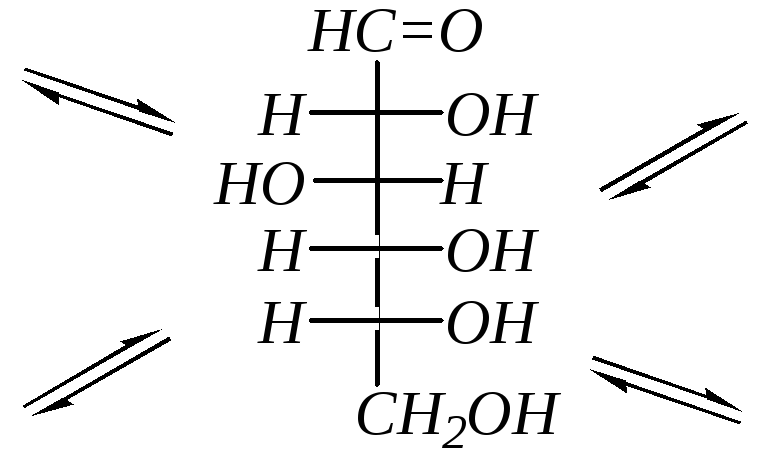
Так как по химической структуре альдопентозы, альдогексозы, кетогексозы являются одновременно -гидрокси- и -гидроксикарбонильными соединениями, то они должны легко образовывать циклические полуацетали. Например, для D-рибозы:
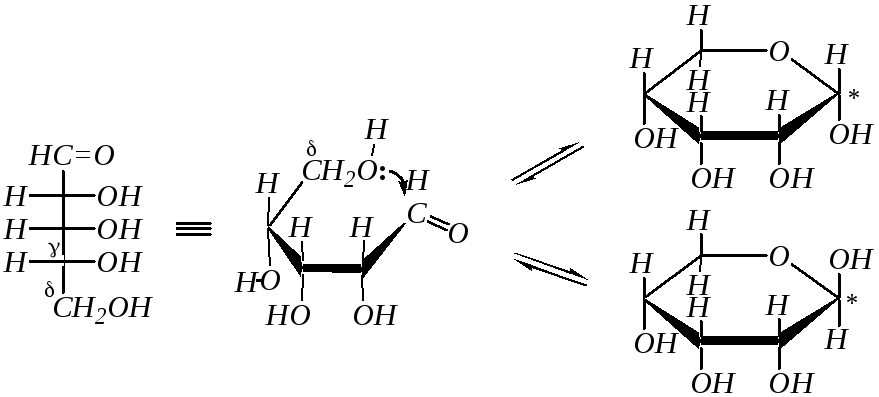
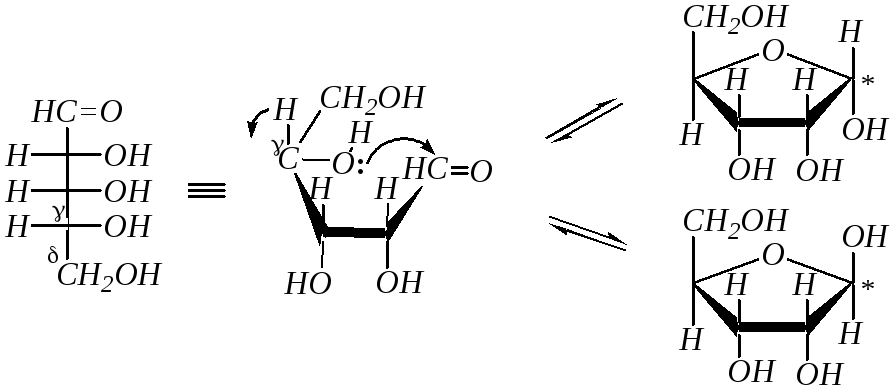
В результате этого образуются четыре циклических формы, что связано с появлением ещё одного хирального центра (атома углерода, связанного с полуацетальным гидроксилом — в схеме отмечен звёздочкой). Полуацетальную гидроксильную группу в химии углеводов называют также гликозидной. Для изображения циклических форм моносахаридов приняты перспективные (пространственные) формулы, предложенные У. Хеуорсом* в 1926 г. (как показано в схеме).
При построении формул Хеуорса цикл условно считают плоским (на самом деле шестичленный цикл может быть в конформации «кресла» или «ванны») и проецируют на плоскость под некоторым углом; при этом ближняя к наблюдателю часть кольца располагается снизу и обычно выделяется более жирной линией. Кислородный атом цикла располагают обычно на наибольшем удалении от наблюдателя. Атомы и группы атомов, изображаемые в формулах Фишера слева и справа, в формулах Хеуорса располагаются соответственно над и под плоскостью цикла. Боковые цепи при атомах С4 в альдопентозах и кетогексозах или С5 в альдогексозах изображают над плоскостью при D-конфигурации атома углерода и под плоскостью при L-конфигурации.
Образование циклического полуацеталя это пример таутомерного превращения. Такое явление в химии углеводов называется цикло-оксотаутомерией или кольчато-цепной таутомерией (о таутомерии — в гл. 3.8.2.1). В зависимости от того, за счёт какой гидроксильной группы (- или -) образуется та или иная циклическая форма, возможно существование пиранозных и фуранозных циклических форм, которые можно рассматривать как производные соответствующих гетероциклов пирана и фурана:

пиран фуран
Образование пяти- и шестичленных циклов связано с их термодинамической устойчивостью по сравнению с малыми циклами (трёх- и четырёхчленными) и циклами большего размера.
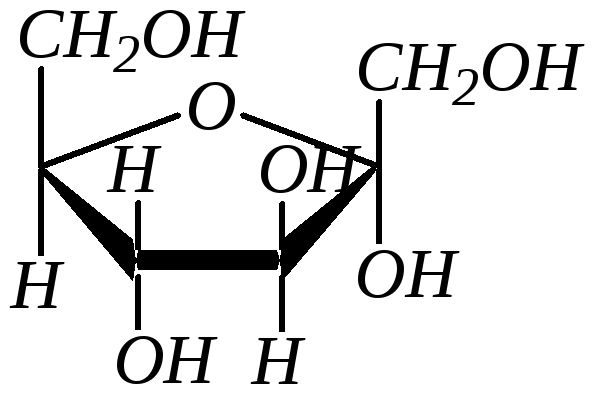
В зависимости от расположения гликозидной (полуацетальной) гидроксильной группы относительно усреднённой плоскости кольца возможна дополнительная пара оптических изомеров, называемых аномерами (-аномер и -аномер). Аномеры представляют собой частный случай эпимеров. Принадлежность к - или -форме определяется конфигурацией аномерного атома углерода (для альдоз – это С1, для кетоз – это, как правило, С2). В молекуле -аномера относительные конфигурации аномерного атома углерода и последнего асимметрического атома в углеродной цепи совпадают. В молекуле -аномера, наоборот, не совпадают. Или иначе принадлежность к - или -форме в формулах Хеуорса можно определить, сравнивая взаимное положение полуацетального гидроксила и группы атомов, не входящих в цикл (часто это СН2ОН-группа). Цис-расположение этих групп определяет -форму, транс-расположение -форму. Например, D-глюкоза существует в следующих пяти формах:
|
-аномер |
|
-аномер |
|
-аномер |
-аномер |
Полное название моносахарида включает обозначение конфигурации аномерного атома углерода (- или -) и размера цикла (пиранозный или фуранозный). Например:

,D-глюкопираноза ,D-рибофураноза
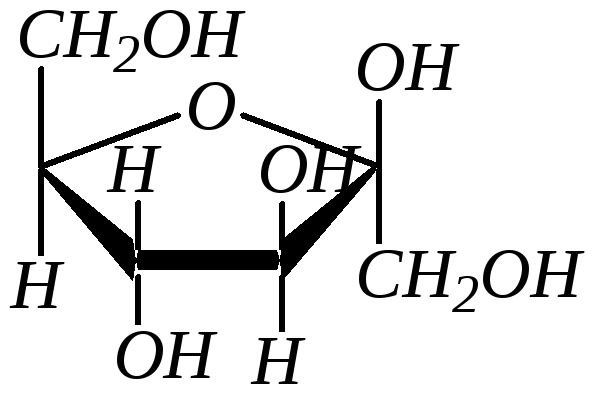
Для кетоз образование циклических форм происходит аналогично альдозам. Например, фуранозные формы фруктозы:
|
D-фруктоза |
,D-фруктофураноза
|
|
,D-фруктофураноза |
В твёрдом состоянии все моносахариды находятся преимущественно в пиранозной форме, как самой устойчивой из возможных циклических форм. При кристаллизации из чистого растворителя можно получить чистые препараты - и -аномеров, так при перекристаллизации D-глюкозы из спирта получают ,D-глюкопиранозу, а из пиридина — ,D-глюкопиранозу. Разные аномеры (- и -) D-глюкозы различаются величиной удельного вращения: у -аномера +112, у -аномера +19. У свежеприготовленного раствора каждого аномера со временем происходит изменение удельного вращения до некоторого постоянного значения. В растворах образуется равновесная смесь всех циклических форм и оксоформы. Для водных растворов D-глюкозы этот угол +52,5. Это происходит вследствие аномеризации, т.е. взаимопревращения - и -аномеров друг в друга через промежуточную оксоформу, и установления таутомерного равновесия. Связанное с этим явлением изменение угла вращения плоскости поляризованного света называется мутаротацией.
Различные конформации циклических форм моносахаридов можно рассматривать только для пиранозных циклов (фуранозное кольцо, аналогичное циклопентановому, почти плоское, и энергии конформационных переходов здесь минимальны). Пиранозное кольцо аналогично циклогексановому, для которого термодинамически более устойчива конформация «кресла». В целом на термодинамическую устойчивость пиранозных форм моносахаридов влияет пространственное расположение громоздких функциональных групп. С этим связано образование в большем или меньшем количестве того или иного аномера. Так, например, ,D-глюкопираноза моносахарид с полным экваториальным расположением заместителей:

Поэтому, как считается, из-за высокой термодинамической устойчивости она обладает широкой распространённостью в природе.
Однако во многих случаях при оценке термодинамической устойчивости молекул моносахаридов для объяснения преобладания - или -аномерных форм и вообще распространённости в природе тех или иных моносахаридов необходимо учитывать возможность образования водородных связей, как внутримолекулярных, так и межмолекулярных.