
- •Глава 1. Основы теоретических представлений в органической химии
- •1.1. Учение а.М. Бутлерова
- •1.2. Теория гибридизации атомных орбиталей
- •1.3. Ковалентная связь
- •1.3.3. Водородные связи
- •1.4. Теория электронных смещений
- •1.5. Классификация и номенклатура органических соединений
- •1.5.1. Заместительная номенклатура
- •1.5.2. Радикало-функциональная номенклатура
- •1.5.4. Рациональная Номенклатура
- •1.6. Представление о Кислотно-оснÓвных свойствах органических соединений
- •1.7. Основы стереохимии
- •1.7.1. Оптическая изомерия
- •1.7.2. Геометрическая изомерия
- •1.7.3. Конформационная изомерия
- •1.8. Классификация органических реакций. Понятие о механизме реакций. Растворители и катализаторы
- •1.9. Методы идентификации органических соединений. Основные физические константы
- •1.10. Методы разделения и очистки органических веществ
- •1.10.1. Разделение твёрдых смесей и очистка твёрдых веществ
- •1.10.2. Разделение жидких смесей и очистка жидкостей
- •1.11. Представление о биологическом действии и метаболизме органических соединений
- •Глава 2. Алканы
- •2.1. Номенклатура. Изомерия
- •2.2. Строение
- •2.3. Физические свойства
- •2.4. Химические свойства
- •2.4.1. Реакции радикального замещения
- •2.4.2. Реакции дегидрирования и разложения
- •2.4.3. Реакции изомеризации
- •Способы получения и природные источники
- •2.6. Применение и физиологическая роль
- •Глава 3. Функциональные производные алканов
- •3.1. ОбщноСть Химических свойств
- •3.1.1. Реакции нуклеофильного замещения
- •3.1.2. Реакции отщепления (элиминирования)
- •3.2. Галогеналканы
- •3.2.1. Классификация, номенклатура, изомерия
- •3.2.2. Строение и свойства
- •3.2.3. Способы получения
- •3.2.4. Полигалогеналканы
- •3.2.5. Физиологическая роль и Важнейшие представители
- •3.3. Насыщенные спирты
- •3.3.1. Классификация, номенклатура, изомерия
- •3.3.2. Строение и физические свойства
- •3.3.3. Химические свойства
- •3.3.4. Способы получения
- •3.3.5. Многоатомные спирты
- •3.3.6. Физиологическое действие
- •3.3.7. Важнейшие представители
- •3.4. Простые насыщенные эфиры
- •3.4.1. Номенклатура и изомерия
- •3.4.2. Физические и химические свойства
- •3.4.3. Способы получения
- •3.4.4. Циклические простые эфиры
- •3.4.5. Физиологическая роль и Важнейшие представители
- •3.5. Эфиры минеральных кислот
- •3.5.1. Эфиры серной кислоты
- •3.5.2. Эфиры фосфорной кислоты
- •3.6. Тиоспирты и тиоэфиры
- •3.7. Насыщенные амины
- •3.7.1. Классификация, номенклатура, изомерия
- •3.7.2. Физические свойства
- •3.7.3. Строение и химические свойства
- •3.7.4. Способы получения
- •3.7.5. Физиологическая роль и Важнейшие представители
- •3.8. Нитроалканы
- •3.8.1. Строение
- •3.8.2. Свойства
- •3.8.3. Способы получения
- •3.8.4. Физиологическое действие и Важнейшие представители
- •3.9. Кремний-, фосфор- и мышьякорганические соединения
- •3.9.1. Кремнийорганические соединения
- •3.9.2. Фосфорорганические соединения
- •3.9.3. Мышьякорганические соединения
- •Глава 4. Непредельные углеводороды
- •4.1. ОБщность строения и химических свойств
- •4.1.1. Реакции электрофильного присоединения
- •4.1.2. Реакции радикального присоединения
- •4.1.3. Реакции радикального замещения
- •4.1.4. Другие реакции
- •4.2. Этиленовые углеводороды
- •4.2.1. Номенклатура, изомерия
- •4.2.2. Физические свойства
- •4.2.3. Химические свойства
- •4.2.4. Способы получения
- •4.2.5. Физиологическое действие и Важнейшие представители
- •4.3. Диеновые (и полиеновые) углеводороды
- •4.3.1. Классификация, номенклатура
- •4.3.5. Способы получения
- •4.3.6. Важнейшие представители
- •4.4. Ацетиленовые углеводороды
- •4.4.1. Номенклатура, изомерия
- •4.4.2. Особенности строения и свойств
- •4.4.3. Способы получения
- •4.4.4. Физиологическое действие и Важнейшие представители
- •Глава 5. Функциональные производные непредельнЫх углеводороДов
- •5.1. ОБщность строения и химических свойств
- •5.1.1. Классификация
- •5.1.2. Субстраты винильного типа
- •5.1.3. Субстраты аллильного типа
- •5.2. Галогеналкены
- •5.2.1. Винилгалогениды
- •5.2.2. Аллилгалогениды
- •5.2.3. Способы получения
- •5.2.4. Важнейшие представители
- •5.3. Непредельные спирты и эфиры
- •5.3.1. Виниловый спирт и его эфиры
- •5.3.2. Аллиловый и пропаргиловый спирты
- •5.3.3. Способы получения
- •5.3.4. Важнейшие представители
- •Глава 6. Алифатические альдегиды, кетоны и карбоновые кислоты
- •6.1. Насыщенные альдегиды и кетоны
- •6.1.1. Изомерия, номенклатура
- •6.1.2. Строение карбонильной группы
- •6.1.3. Физические свойства
- •6.1.4. Химические свойства
- •6.1.5. Способы получения
- •6.1.6. Физиологическая роль
- •6.1.7. Важнейшие представители
- •6.2. Непредельные альдегиды и кетоны
- •6.2.1. Кетен
- •6.2.2. Непредельные карбонильные соединения
- •Примерами соединений с сопряжёнными -связями являются
- •6.2.3. Важнейшие представители
- •6.3. Дикарбонильные соединения
- •6.3.3. Важнейшие представители
- •6.4. Насыщенные монокарбоновые кислоты и их производные
- •6.4.1. Номенклатура
- •6.4.2. Строение функциональной группы
- •6.4.3. Физические свойства
- •6.4.4. Химические свойства
- •6.4.5. Способы получения
- •6.4.6. Пероксикарбоновые кислоты и ацилпероксиды
- •6.4.7. Физиологическая роль и Важнейшие представители
- •6.5. Непредельные монокарбоновые кислоты
- •6.5.1. Номенклатура, изомерия
- •6.5.2. Строение
- •6.5.3. Химические свойства
- •6.5.4. Способы получения
- •6.5.5. Физиологическая роль и Важнейшие представители
- •6.5.6. Омыляемые липиды
- •6.6. Дикарбоновые кислоты и их производные
- •6.6.1. Особенности химического поведения
- •6.6.2. Малоновый эфир и синтезы на его основе
- •2 H5c2ooc-ch2-cooc2h5
- •2 H5c2ooc-ch2-cooc2h5
- •6.6.3. Способы получения
- •2 Rooc-(ch2)n-сoo¯ 2 rooc-(ch2)n-сoo rooc-(ch2)2n-coor hooc-(ch2)2n-cooh
- •6.6.4. Важнейшие представители
- •6.7. Гидроксикислоты
- •6.7.1. Классификация, номенклатура, изомерия
- •6.7.2. Химические свойства
- •6.7.3. Способы получения
- •6.7.4. Физиологическая роль и Важнейшие представители
- •6.8. Оксокислоты
- •6.8.1. Особенности химического поведения
- •6.8.2. Ацетоуксусный эфир и синтезы на его основе
- •6.8.3. Способы получения
- •6.8.4. Важнейшие представители
- •6.9. Аминокарбоновые кислоты. Пептиды
- •6.9.1. Классификация, номенклатура, изомерия аминокислот
- •6.9.2. Строение, физические и Химические свойства
- •6.9.3. Способы получения аминокислот
- •6.9.4. Важнейшие представители аминокислот
- •6.9.5. Пептиды
- •Глава 7. Углеводы
- •7.1. Моносахариды
- •7.1.1. Изомерия, номенклатура
- •7.1.2. Химические свойства
- •7.1.3. Важнейшие представители моносахаридов и их производных
- •7.2. Олигосахариды
- •7.2.1. Классификация и номенклатура дисахаридов
- •7.2.2. Химические свойства дисахаридов
- •7.2.3. Важнейшие представители дисахаридов
- •7.3. Полисахариды
- •7.3.1. Целлюлоза
- •7.3.2. Амилоза и амилопектин
- •7.3.3. Гликоген
- •7.3.4. Декстраны
- •7.3.5. Хитин
- •7.3.6. Пектовая кислота
- •7.3.7. Гетерополисахариды
- •Глава 8. Алициклические углеводороды и их производные
- •8.1. Номенклатура моно- и бициклических соединений
- •8.2. Пространственное строение и изомерия циклоалканов
- •8.2.1. Циклопропан
- •8.2.2. Циклобутан
- •8.2.3. Циклопентан
- •8.2.4. Циклогексан
- •8.3. Химические свойства
- •8.3.1. Реакции циклопропана, циклопропена и их производных
- •8.3.2. Реакции циклобутана и его производных
- •8.3.3. Реакции средних циклов
- •8.3.4. Реакции изомеризации цикла
- •8.4. Способы получения циклоалканов
- •8.5. Терпены и терпеноиды. Каротиноиды
- •8.5.1. Ациклические терпены и терпеноиды
- •8.5.2. Моноциклические терпены и терпеноиды
- •8.5.3. Бициклические терпены и терпеноиды
- •8.5.4. Каротиноиды
- •8.6. Физиологическая роль и важнейшие представители
- •8.7. Стероиды
- •Глава 9. Бензол. Ароматичность. Углеводороды ряда бензола
- •9.1. Строение бензола
- •Тепловой эффект реакции гидрирования бензола составляет
- •9.2. Номенклатура и изомерия аренов
- •9.3. Строение аренов
- •9.3.1. Строение толуола
- •9.3.2. Строение винилбензола
- •9.4. Физические свойства
- •9.5. Химические Свойства
- •9.5.1. Химические свойства бензола
- •9.5.2. Химические свойства аренов
- •9.6. Способы получения
- •9.7. Физиологическое действие и важнейшие представители аренов
- •9.8. Небензоидные ароматические системы
- •Глава 10. Функциональные производные углеводородов ряда бензола
- •10.1. Общность строения и свойств монозамещённых бензолов
- •10.1.1. Электронные эффекты заместителей
- •10.1.2. Реакции электрофильного замещения
- •10.1.3. Реакции нуклеофильного замещения
- •10.2. Галогенарены
- •10.2.1. Классификация, номенклатура
- •10.2.2. Строение арилгалогенидов
- •10.2.3. Физические свойства
- •10.2.4. Химические свойства
- •10.2.5. Способы получения
- •10.2.6. Важнейшие представители
- •10.3. Ароматические сульфокислоты
- •10.3.1. Номенклатура
- •10.3.2. Строение
- •10.3.3. Физические и химические свойства
- •10.3.4. Способы получения
- •10.3.5. Производные сульфокислот
- •10.3.6. Медико-биологическое значение и Важнейшие представители
- •10.4. Ароматические нитросоединения
- •10.4.1. Строение нитробензола
- •10.4.2. Физические свойства
- •10.4.3. Химические свойства
- •10.4.4. Способы получения
- •10.4.5. Физиологическое действие и Важнейшие представители
- •10.5. Фенолы. Ароматические спирты. Хиноны
- •10.5.1. Классификация, номенклатура, изомерия фенолов и ароматических спиртов
- •10.5.2. Строение фенола и бензилового спирта
- •Ароматические амины и продукты неполного восстановления нитросоединений
- •10.6.1. Классификация, номенклатура, изомерия ароматических аминов
- •10.6.2. Строение анилина
- •10.6.3. Физические и химические свойства ароматических аминов
- •10.6.4. Способы получения ароматических аминов
- •10.6.5. Важнейшие представители ароматических аминов
- •10.6.6. Продукты неполного восстановления нитросоединений
- •10.7. Ароматические диазосоединения
- •10.7.2. Механизм образования солей арендиазония и строение катиона бензолдиазония
- •10.7.3. Амфотерность диазосоединений
- •10.7.4. Реакции солей арендиазония
- •10.8. Ароматические альдегиды и кетоны
- •10.9. Ароматические карбоновые кислоты и их производные
- •10.10. Физиологическая роль функциональных производных бензола
- •Глава 11. Полициклические ароматические углеводороды и их производные
- •11.1. Классификация углеводородов с конденсированными циклами
- •11.2. Нафталин
- •11.2.1. Строение, изомерия, номенклатура
- •11.2.2. Свойства
- •11.2.3. Способы получения
- •11.2.4. Важнейшие представители
- •11.3. Антрацен
- •11.3.1. Строение, изомерия, номенклатура
- •11.3.2. Свойства
- •Продукт исчерпывающего гидрирования (пергидроантрацен) можно получить, проводя реакцию в жёстких условиях с применением металлических катализаторов.
- •11.3.3. Способы получения
- •11.3.4. Важнейшие представители
- •11.4. Фенантрен
- •11.4.1. Строение, изомерия, номенклатура
- •11.4.2. Свойства
- •11.4.3. Способы получения
- •11.5. Физиологическое действие полициклических углеводородов
- •Глава 12. Гетероциклические соединения
- •12.1. Классификация и номенклатура
- •12.2. Пятичленные гетероциклические
- •12.2.1. Номенклатура пиррола, фурана и тиофена и их производных
- •12.2.2. Строение пиррола, фурана и тиофена
- •12.2.3. Физические и химические свойства пиррола, фурана и тиофена
- •12.2.4. Особенности индола
- •12.2.5. Способы получения пиррола, фурана, тиофена, индола
- •12.2.6. Важнейшие представители и медико-биологическое значение
- •12.3. Пятичленные гетероциклические
- •12.3.1. Номенклатура имидазола и пиразола
- •12.3.2. Строение имидазола и пиразола
- •12.3.3. Физические и химические свойства имидазола и пиразола
- •12.3.4. Способы получения
- •12.3.5. Важнейшие представители и медико-биологическое значение
- •12.4. Шестичленные гетероциклические
- •12.4.1. Номенклатура пиридина и его производных
- •12.4.2. Строение пиридина
- •12.4.3. Химические свойства пиридина
- •Но если оба -положения заняты, то замещается водород в-положении. При нагревании с избытком амида натрия можно получить 2,6-диаминопиридин.
- •12.4.4. Особенности химического поведения пиколинов и функциональных производных пиридина
- •12.4.5. Хинолин и изохинолин
- •12.4.7. Способы получения
- •Реакция аналогична получению бензола, протекает при высоких температурах, но представляет только теоретический интерес.
- •12.4.8. Важнейшие представители и медико-биологическое значение
- •12.5. Шестичленные гетероциклические
- •12.5.1. Строение и свойства диазинов
- •12.5.2. Пурин
- •12.5.3. Способы получения
- •12.5.4. Важнейшие представители и медико-биологическое значение
- •12.5.5. Нуклеозиды, нуклеотиды и нуклеиновые кислоты
- •12.6. Алкалоиды
11.2.2. Свойства
Нафталин — бесцветное кристаллическое вещество, летучее, с характерным запахом. Температура плавления 353 К, температура кипения 491 К. Аналогично углеводородам ряда бензола нафталин незначительно растворим в воде, но хорошо — в неполярных и малополярных органических растворителях.
Химические свойства нафталина должны определяться, с одной стороны, наличием ароматической системы, а с другой стороны — способностью к взаимодействиям, связанным с присутствием диенового фрагмента.
11.2.2.1. Электрофильное замещение
Реакции SE для нафталина протекают легче, чем для бензола. Это объясняется: 1) неравномерностью распределения -электронной плотности, а значит, большей скоростью образования -комплекса; 2) сохранением ароматичности системы на стадии образования -комплекса, что не требует затрат на преодоление энергии делокализации ароматического кольца.
Направление электрофильного замещения — преимущественно в -положение. Это можно объяснить сравнением устойчивости -комплексов, представив нафталиновую систему чередующимися -связями и учитывая повышенный -характер связи С1–С2:

Так как связь С9–С10 имеет низкий -характер, то полного сопряжения между кольцами нет или, другими словами, -электронная проводимость между кольцами невелика. Поэтому граничные структуры представлены без учёта участия второго кольца в делокализации положительного заряда.
Типичными примерами SE-реакций здесь являются нитрование, сульфирование и хлорирование. Нитрование смесью концентрированных азотной и серной кислот протекает легко и в избытке реагента при 320 К приводит к смеси 1,5- и 1,8-динитронафталинов:


1,5-динитронафталин 1,8-динитронафталин
То есть как первая, так и вторая нитрогруппы вводятся в одно из -положений. Но реакция введения второй нитрогруппы осуществляется в другое, незамещённое, кольцо. Причина же лёгкого введения второй нитрогруппы в молекулу нафталина заключается прежде всего в слабой -электронной проводимости между кольцами, и поэтому акцепторное влияние нитрогруппы на величину -электронной плотности в незамещённом кольце мононитронафталина незначительно. Это и приводит к образованию динитропроизводных примерно в тех же условиях, что и мононитропроизводных.
Сульфирование нафталина в обычных условиях, так же как и нитрование, приводит к моно- и дизамещённым производным. Однако структура молекул продуктов сульфирования здесь сильно зависит от температурного режима. (Похожее явление наблюдалось при сульфировании фенола – гл. 10.5.3.3.) -Изомер образуется при 333 К, но при температуре 433 К он перегруппировывается в термодинамически более стабильный -изомер:

Вторая сульфогруппа вводится в незамещённое кольцо. При этом из -нафталинсульфокислоты образуется в основном смесь 1,5-, 1,7- и 2,7-нафталиндисульфокислот (причём при низкой температуре преимущественно 1,5-изомердо 60—70% от теоретического), а из-изомера — смесь 1,6-, 1,7-, 2,6- и 2,7-нафталиндисульфокислот. Хотя при продолжительном нагревании в любом случае образуются только две нафталиндисульфокислоты — 2,6- и 2,7-изомеры:

Хлорирование нафталина на хлориде алюминия протекает при 383 К. При монохлорировании образуется в основном -изомер. Дальнейшее введение атомов хлора протекает неселективно как в одно, так и в оба кольца. Среди дихлорпроизводных преобладают 1,4- и 1,5-изомеры (возможно, по пространственным причинам). Но в избытке хлора продолжительное проведение реакции приводит к перхлорнафталину:

1-хлорнафталин
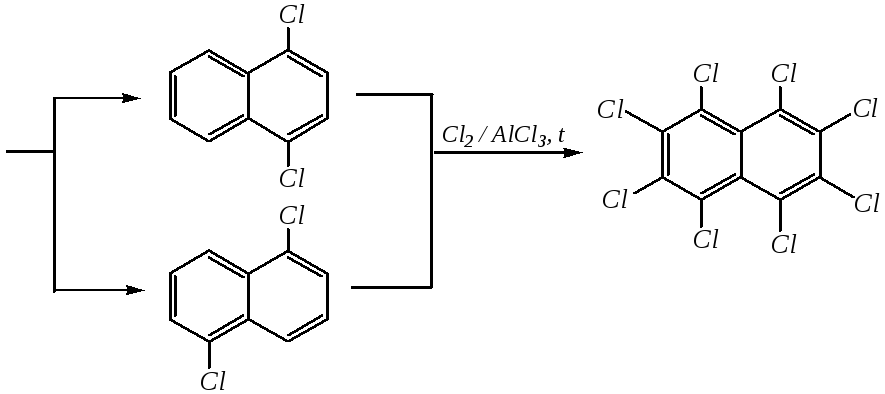
1,4- и 1,5-дихлорнафталины
Причина такого направления протекания реакции хлорирования, в отличие от нитрования и сульфирования, в значительно меньшем акцепторном влиянии атома хлора как заместителя в ароматическом кольце, что и делает электрофильное замещение неселективным.
В целом для монозамещённых нафталинов влияние заместителя распространяется, главным образом, на замещённое кольцо. Если активирующая электронодонорная группа находится у -углеродного атома, электрофил направляется, как правило, в четвёртое положение (в меньшей степени во второе). Типичным примером может служить нитрование -нафтола, причём продуктом динитрования является 2,4-динитронафтол-1:
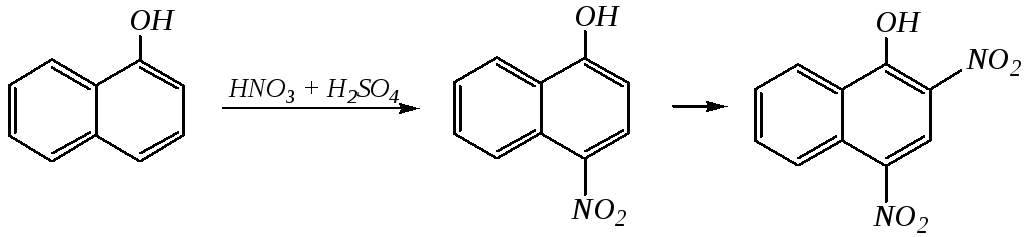
нафтол-1 4-нитронафтол-1 2,4-динитронафтол-1
Если же электронодонорный заместитель находится у -углеродного атома, то электрофильная атака направляется в первое положение.
Дезактивирующая электроноакцепторная группа направляет атаку электрофила в соседнее незамещённое кольцо, при этом, как правило, по -углеродным атомам (например, см. выше нитрование). Но условия реакции (как при сульфировании) могут оказывать влияние на её направление.
11.2.2.2. Реакции присоединения
Эти реакции подтверждают диеновый характер нафталиновой системы. Важнейшими из них являются гидрирование, галогенирование и реакции диенового синтеза.
Проведение реакции гидрирования возможно в разных условиях. Присоединение молекулярного водорода на хромоникелевом катализаторе приводит сначала к тетрагидропроизводному:
|
|
|
|
тетралин
(1,2,3,4-тетрагидронафталин),
а затем – к пергидропроизводному, но в значительно более жёстких условиях:
|
|
|
|
декалин
(пергидронафталин)
Из этих двух реакций в первой нафталин проявляет свойства диеновой системы, а во второй происходит нарушение ароматической системы кольца. Отсюда и различия в условиях протекания реакций: первая — аналогично диенам, вторая — аналогично алкилбензолам.
Гидрирование атомарным водородом (водородом в момент выделения) проводят металлическим натрием в кипящих этаноле или пентаноле-1. Продукты реакций при этом могут различаться:

1,4-дигидронафталин 1,2-дигидронафталин

тетралин
Реакции в обоих случаях начинаются как 1,4-присоединение, но в этаноле промежуточный продукт перегруппировывается в 1,2-дигидронафталин, стабилизированный --сопряжением, а в пентаноле-1, при более высокой температуре, реакция протекает дальше до образования продукта полного гидрирования диенового фрагмента.
Восстановление по Бёрчу (гл. 9.5.1.2, 9.5.2.2) селективно приводит к 1,4-дигидронафталину:

Галогенирование также начинается как реакция 1,4-присоединения, но затем наблюдается отщепление молекулы галогеноводорода, так как продукт реакции элиминирования оказывается более стабилен по причине того же --сопряжения:

В реакции диенового синтеза (гл. 4.3.3) нафталин является типичным диеном, а в качестве диенофила может быть, например, дицианоацетилен:

11.2.2.3. Окисление
Энергичное окисление кислородом на ванадиевом катализаторе приводит к разрушению одного кольца и образованию фталевого ангидрида:

Эта реакция для монозамещённых нафталинов протекает по кольцу, имеющему бóльшую -электронную плотность. Так, например, в молекуле -аминонафталина разрушается замещённое кольцо, содержащее электронодонор:

А в молекуле -нитронафталина, наоборот, разрушается незамещённое кольцо, так как заместитель понижает электронную плотность, что препятствует реакции окисления:

Мягкое окисление нафталина и его производных также возможно. Причём нафталины окисляются легче, чем гомологи бензола, и эта реакция приводит обычно к образованию нафтохинонов:

2-метилнафтохинон-1,4




