
- •Глава 1. Основы теоретических представлений в органической химии
- •1.1. Учение а.М. Бутлерова
- •1.2. Теория гибридизации атомных орбиталей
- •1.3. Ковалентная связь
- •1.3.3. Водородные связи
- •1.4. Теория электронных смещений
- •1.5. Классификация и номенклатура органических соединений
- •1.5.1. Заместительная номенклатура
- •1.5.2. Радикало-функциональная номенклатура
- •1.5.4. Рациональная Номенклатура
- •1.6. Представление о Кислотно-оснÓвных свойствах органических соединений
- •1.7. Основы стереохимии
- •1.7.1. Оптическая изомерия
- •1.7.2. Геометрическая изомерия
- •1.7.3. Конформационная изомерия
- •1.8. Классификация органических реакций. Понятие о механизме реакций. Растворители и катализаторы
- •1.9. Методы идентификации органических соединений. Основные физические константы
- •1.10. Методы разделения и очистки органических веществ
- •1.10.1. Разделение твёрдых смесей и очистка твёрдых веществ
- •1.10.2. Разделение жидких смесей и очистка жидкостей
- •1.11. Представление о биологическом действии и метаболизме органических соединений
- •Глава 2. Алканы
- •2.1. Номенклатура. Изомерия
- •2.2. Строение
- •2.3. Физические свойства
- •2.4. Химические свойства
- •2.4.1. Реакции радикального замещения
- •2.4.2. Реакции дегидрирования и разложения
- •2.4.3. Реакции изомеризации
- •Способы получения и природные источники
- •2.6. Применение и физиологическая роль
- •Глава 3. Функциональные производные алканов
- •3.1. ОбщноСть Химических свойств
- •3.1.1. Реакции нуклеофильного замещения
- •3.1.2. Реакции отщепления (элиминирования)
- •3.2. Галогеналканы
- •3.2.1. Классификация, номенклатура, изомерия
- •3.2.2. Строение и свойства
- •3.2.3. Способы получения
- •3.2.4. Полигалогеналканы
- •3.2.5. Физиологическая роль и Важнейшие представители
- •3.3. Насыщенные спирты
- •3.3.1. Классификация, номенклатура, изомерия
- •3.3.2. Строение и физические свойства
- •3.3.3. Химические свойства
- •3.3.4. Способы получения
- •3.3.5. Многоатомные спирты
- •3.3.6. Физиологическое действие
- •3.3.7. Важнейшие представители
- •3.4. Простые насыщенные эфиры
- •3.4.1. Номенклатура и изомерия
- •3.4.2. Физические и химические свойства
- •3.4.3. Способы получения
- •3.4.4. Циклические простые эфиры
- •3.4.5. Физиологическая роль и Важнейшие представители
- •3.5. Эфиры минеральных кислот
- •3.5.1. Эфиры серной кислоты
- •3.5.2. Эфиры фосфорной кислоты
- •3.6. Тиоспирты и тиоэфиры
- •3.7. Насыщенные амины
- •3.7.1. Классификация, номенклатура, изомерия
- •3.7.2. Физические свойства
- •3.7.3. Строение и химические свойства
- •3.7.4. Способы получения
- •3.7.5. Физиологическая роль и Важнейшие представители
- •3.8. Нитроалканы
- •3.8.1. Строение
- •3.8.2. Свойства
- •3.8.3. Способы получения
- •3.8.4. Физиологическое действие и Важнейшие представители
- •3.9. Кремний-, фосфор- и мышьякорганические соединения
- •3.9.1. Кремнийорганические соединения
- •3.9.2. Фосфорорганические соединения
- •3.9.3. Мышьякорганические соединения
- •Глава 4. Непредельные углеводороды
- •4.1. ОБщность строения и химических свойств
- •4.1.1. Реакции электрофильного присоединения
- •4.1.2. Реакции радикального присоединения
- •4.1.3. Реакции радикального замещения
- •4.1.4. Другие реакции
- •4.2. Этиленовые углеводороды
- •4.2.1. Номенклатура, изомерия
- •4.2.2. Физические свойства
- •4.2.3. Химические свойства
- •4.2.4. Способы получения
- •4.2.5. Физиологическое действие и Важнейшие представители
- •4.3. Диеновые (и полиеновые) углеводороды
- •4.3.1. Классификация, номенклатура
- •4.3.5. Способы получения
- •4.3.6. Важнейшие представители
- •4.4. Ацетиленовые углеводороды
- •4.4.1. Номенклатура, изомерия
- •4.4.2. Особенности строения и свойств
- •4.4.3. Способы получения
- •4.4.4. Физиологическое действие и Важнейшие представители
- •Глава 5. Функциональные производные непредельнЫх углеводороДов
- •5.1. ОБщность строения и химических свойств
- •5.1.1. Классификация
- •5.1.2. Субстраты винильного типа
- •5.1.3. Субстраты аллильного типа
- •5.2. Галогеналкены
- •5.2.1. Винилгалогениды
- •5.2.2. Аллилгалогениды
- •5.2.3. Способы получения
- •5.2.4. Важнейшие представители
- •5.3. Непредельные спирты и эфиры
- •5.3.1. Виниловый спирт и его эфиры
- •5.3.2. Аллиловый и пропаргиловый спирты
- •5.3.3. Способы получения
- •5.3.4. Важнейшие представители
- •Глава 6. Алифатические альдегиды, кетоны и карбоновые кислоты
- •6.1. Насыщенные альдегиды и кетоны
- •6.1.1. Изомерия, номенклатура
- •6.1.2. Строение карбонильной группы
- •6.1.3. Физические свойства
- •6.1.4. Химические свойства
- •6.1.5. Способы получения
- •6.1.6. Физиологическая роль
- •6.1.7. Важнейшие представители
- •6.2. Непредельные альдегиды и кетоны
- •6.2.1. Кетен
- •6.2.2. Непредельные карбонильные соединения
- •Примерами соединений с сопряжёнными -связями являются
- •6.2.3. Важнейшие представители
- •6.3. Дикарбонильные соединения
- •6.3.3. Важнейшие представители
- •6.4. Насыщенные монокарбоновые кислоты и их производные
- •6.4.1. Номенклатура
- •6.4.2. Строение функциональной группы
- •6.4.3. Физические свойства
- •6.4.4. Химические свойства
- •6.4.5. Способы получения
- •6.4.6. Пероксикарбоновые кислоты и ацилпероксиды
- •6.4.7. Физиологическая роль и Важнейшие представители
- •6.5. Непредельные монокарбоновые кислоты
- •6.5.1. Номенклатура, изомерия
- •6.5.2. Строение
- •6.5.3. Химические свойства
- •6.5.4. Способы получения
- •6.5.5. Физиологическая роль и Важнейшие представители
- •6.5.6. Омыляемые липиды
- •6.6. Дикарбоновые кислоты и их производные
- •6.6.1. Особенности химического поведения
- •6.6.2. Малоновый эфир и синтезы на его основе
- •2 H5c2ooc-ch2-cooc2h5
- •2 H5c2ooc-ch2-cooc2h5
- •6.6.3. Способы получения
- •2 Rooc-(ch2)n-сoo¯ 2 rooc-(ch2)n-сoo rooc-(ch2)2n-coor hooc-(ch2)2n-cooh
- •6.6.4. Важнейшие представители
- •6.7. Гидроксикислоты
- •6.7.1. Классификация, номенклатура, изомерия
- •6.7.2. Химические свойства
- •6.7.3. Способы получения
- •6.7.4. Физиологическая роль и Важнейшие представители
- •6.8. Оксокислоты
- •6.8.1. Особенности химического поведения
- •6.8.2. Ацетоуксусный эфир и синтезы на его основе
- •6.8.3. Способы получения
- •6.8.4. Важнейшие представители
- •6.9. Аминокарбоновые кислоты. Пептиды
- •6.9.1. Классификация, номенклатура, изомерия аминокислот
- •6.9.2. Строение, физические и Химические свойства
- •6.9.3. Способы получения аминокислот
- •6.9.4. Важнейшие представители аминокислот
- •6.9.5. Пептиды
- •Глава 7. Углеводы
- •7.1. Моносахариды
- •7.1.1. Изомерия, номенклатура
- •7.1.2. Химические свойства
- •7.1.3. Важнейшие представители моносахаридов и их производных
- •7.2. Олигосахариды
- •7.2.1. Классификация и номенклатура дисахаридов
- •7.2.2. Химические свойства дисахаридов
- •7.2.3. Важнейшие представители дисахаридов
- •7.3. Полисахариды
- •7.3.1. Целлюлоза
- •7.3.2. Амилоза и амилопектин
- •7.3.3. Гликоген
- •7.3.4. Декстраны
- •7.3.5. Хитин
- •7.3.6. Пектовая кислота
- •7.3.7. Гетерополисахариды
- •Глава 8. Алициклические углеводороды и их производные
- •8.1. Номенклатура моно- и бициклических соединений
- •8.2. Пространственное строение и изомерия циклоалканов
- •8.2.1. Циклопропан
- •8.2.2. Циклобутан
- •8.2.3. Циклопентан
- •8.2.4. Циклогексан
- •8.3. Химические свойства
- •8.3.1. Реакции циклопропана, циклопропена и их производных
- •8.3.2. Реакции циклобутана и его производных
- •8.3.3. Реакции средних циклов
- •8.3.4. Реакции изомеризации цикла
- •8.4. Способы получения циклоалканов
- •8.5. Терпены и терпеноиды. Каротиноиды
- •8.5.1. Ациклические терпены и терпеноиды
- •8.5.2. Моноциклические терпены и терпеноиды
- •8.5.3. Бициклические терпены и терпеноиды
- •8.5.4. Каротиноиды
- •8.6. Физиологическая роль и важнейшие представители
- •8.7. Стероиды
- •Глава 9. Бензол. Ароматичность. Углеводороды ряда бензола
- •9.1. Строение бензола
- •Тепловой эффект реакции гидрирования бензола составляет
- •9.2. Номенклатура и изомерия аренов
- •9.3. Строение аренов
- •9.3.1. Строение толуола
- •9.3.2. Строение винилбензола
- •9.4. Физические свойства
- •9.5. Химические Свойства
- •9.5.1. Химические свойства бензола
- •9.5.2. Химические свойства аренов
- •9.6. Способы получения
- •9.7. Физиологическое действие и важнейшие представители аренов
- •9.8. Небензоидные ароматические системы
- •Глава 10. Функциональные производные углеводородов ряда бензола
- •10.1. Общность строения и свойств монозамещённых бензолов
- •10.1.1. Электронные эффекты заместителей
- •10.1.2. Реакции электрофильного замещения
- •10.1.3. Реакции нуклеофильного замещения
- •10.2. Галогенарены
- •10.2.1. Классификация, номенклатура
- •10.2.2. Строение арилгалогенидов
- •10.2.3. Физические свойства
- •10.2.4. Химические свойства
- •10.2.5. Способы получения
- •10.2.6. Важнейшие представители
- •10.3. Ароматические сульфокислоты
- •10.3.1. Номенклатура
- •10.3.2. Строение
- •10.3.3. Физические и химические свойства
- •10.3.4. Способы получения
- •10.3.5. Производные сульфокислот
- •10.3.6. Медико-биологическое значение и Важнейшие представители
- •10.4. Ароматические нитросоединения
- •10.4.1. Строение нитробензола
- •10.4.2. Физические свойства
- •10.4.3. Химические свойства
- •10.4.4. Способы получения
- •10.4.5. Физиологическое действие и Важнейшие представители
- •10.5. Фенолы. Ароматические спирты. Хиноны
- •10.5.1. Классификация, номенклатура, изомерия фенолов и ароматических спиртов
- •10.5.2. Строение фенола и бензилового спирта
- •Ароматические амины и продукты неполного восстановления нитросоединений
- •10.6.1. Классификация, номенклатура, изомерия ароматических аминов
- •10.6.2. Строение анилина
- •10.6.3. Физические и химические свойства ароматических аминов
- •10.6.4. Способы получения ароматических аминов
- •10.6.5. Важнейшие представители ароматических аминов
- •10.6.6. Продукты неполного восстановления нитросоединений
- •10.7. Ароматические диазосоединения
- •10.7.2. Механизм образования солей арендиазония и строение катиона бензолдиазония
- •10.7.3. Амфотерность диазосоединений
- •10.7.4. Реакции солей арендиазония
- •10.8. Ароматические альдегиды и кетоны
- •10.9. Ароматические карбоновые кислоты и их производные
- •10.10. Физиологическая роль функциональных производных бензола
- •Глава 11. Полициклические ароматические углеводороды и их производные
- •11.1. Классификация углеводородов с конденсированными циклами
- •11.2. Нафталин
- •11.2.1. Строение, изомерия, номенклатура
- •11.2.2. Свойства
- •11.2.3. Способы получения
- •11.2.4. Важнейшие представители
- •11.3. Антрацен
- •11.3.1. Строение, изомерия, номенклатура
- •11.3.2. Свойства
- •Продукт исчерпывающего гидрирования (пергидроантрацен) можно получить, проводя реакцию в жёстких условиях с применением металлических катализаторов.
- •11.3.3. Способы получения
- •11.3.4. Важнейшие представители
- •11.4. Фенантрен
- •11.4.1. Строение, изомерия, номенклатура
- •11.4.2. Свойства
- •11.4.3. Способы получения
- •11.5. Физиологическое действие полициклических углеводородов
- •Глава 12. Гетероциклические соединения
- •12.1. Классификация и номенклатура
- •12.2. Пятичленные гетероциклические
- •12.2.1. Номенклатура пиррола, фурана и тиофена и их производных
- •12.2.2. Строение пиррола, фурана и тиофена
- •12.2.3. Физические и химические свойства пиррола, фурана и тиофена
- •12.2.4. Особенности индола
- •12.2.5. Способы получения пиррола, фурана, тиофена, индола
- •12.2.6. Важнейшие представители и медико-биологическое значение
- •12.3. Пятичленные гетероциклические
- •12.3.1. Номенклатура имидазола и пиразола
- •12.3.2. Строение имидазола и пиразола
- •12.3.3. Физические и химические свойства имидазола и пиразола
- •12.3.4. Способы получения
- •12.3.5. Важнейшие представители и медико-биологическое значение
- •12.4. Шестичленные гетероциклические
- •12.4.1. Номенклатура пиридина и его производных
- •12.4.2. Строение пиридина
- •12.4.3. Химические свойства пиридина
- •Но если оба -положения заняты, то замещается водород в-положении. При нагревании с избытком амида натрия можно получить 2,6-диаминопиридин.
- •12.4.4. Особенности химического поведения пиколинов и функциональных производных пиридина
- •12.4.5. Хинолин и изохинолин
- •12.4.7. Способы получения
- •Реакция аналогична получению бензола, протекает при высоких температурах, но представляет только теоретический интерес.
- •12.4.8. Важнейшие представители и медико-биологическое значение
- •12.5. Шестичленные гетероциклические
- •12.5.1. Строение и свойства диазинов
- •12.5.2. Пурин
- •12.5.3. Способы получения
- •12.5.4. Важнейшие представители и медико-биологическое значение
- •12.5.5. Нуклеозиды, нуклеотиды и нуклеиновые кислоты
- •12.6. Алкалоиды
10.8. Ароматические альдегиды и кетоны
Так же, как и их алифатические аналоги, ароматические альдегиды и кетоны содержат общий структурный фрагмент — карбонильную группу >C=O. В ароматических альдегидах карбонильная группа связана с ароматическим кольцом, в ароматических кетонах — с одним или двумя ароматическими радикалами (второй углеводородный радикал может быть алифатическим). Поэтому в общем виде ароматические карбонильные соединения можно изобразить следующим образом:

У ароматических альдегидов и кетонов имеются свои отличия в строении и химическом поведении как между собой, так и по сравнению с алифатическими аналогами.
10.8.1. Изомерия, номенклатура
Так же, как и для алифатических карбонильных соединений, для ароматических альдегидов и кетонов характерны скелетная и позиционная разновидности структурной изомерии. Кроме того, среди изомеров ароматических карбонильных соединений можно выделить соединения, содержащие ароматическое кольцо в алифатической углеводородной цепи альдегида или кетона, например:

Такие соединения в ряде случаев тоже относят к ароматическим; однако так как прямое взаимодействие между карбонильной группой и бензольным кольцом практически отсутствует, то здесь они рассматриваться не будут (возможно, за некоторым исключением).
Относительно небольшое число ароматических альдегидов и кетонов имеют распространённые тривиальные названия. Например:

бензальдегид толуиловые анисовый ванилин
альдегиды (о-, м-, п-) альдегид

ацетофенон бензофенон
Из систематических названий альдегидов более всего распространена заместительная номенклатура, по которой к названию циклической системы (арена или другого ароматического соединения) добавляется обозначение «карбальдегид» (гл. 1.5.1), а названия ароматических кетонов (так же как и для алифатических) строятся при помощи суффикса -он. Например:
|
|
— бензолкарбальдегид, |
|
|
|
|
|
— 4-метилбензолкарбальдегид, или п-толуолкарбальдегид, |
|
|
|
|
|
— 1-фенилэтанон. |
Однако для названий кетонов чаще используется радикало-функциональная номенклатура, по которой сначала перечисляются в алфавитном порядке радикалы, связанные с кетонной группой, а затем добавляется слово «кетон». Например, ацетофенон (1-фенилэтанон) получит название метилфенилкетон.
10.8.2. Строение бензальдегида
В
карбонильной группе >C=O-связь
между углеродом и кислородом сильно-полярна
из-за смещения к атому кислорода как
-,
так и -электронов
этой связи (гл. 6.1.2). Но в молекулах
ароматических альдегидов и кетонов
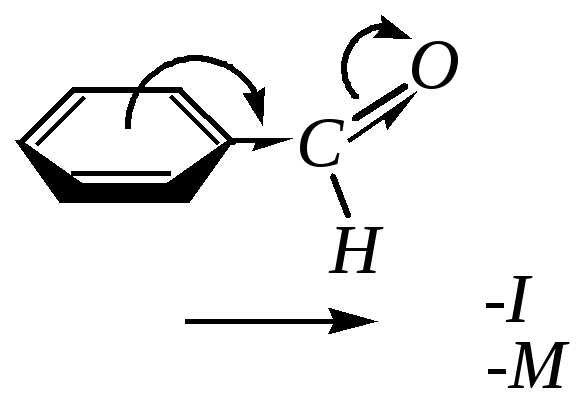 (например,
в бензальдегиде) карбонильная группа
связана с ароматическим кольцом. Поэтому
по отношению к нему альдегидная группа
в молекуле бензальдегида является
сильным электроноакцептором как за
счёт индуктивного, так и за счёт
мезомерного влияния (гл. 10.1.1).
(например,
в бензальдегиде) карбонильная группа
связана с ароматическим кольцом. Поэтому
по отношению к нему альдегидная группа
в молекуле бензальдегида является
сильным электроноакцептором как за
счёт индуктивного, так и за счёт
мезомерного влияния (гл. 10.1.1).
Мезомерный эффект проявляется за счёт перекрывания рz-орбиталей карбонильного атома углерода и атома углерода бензольного кольца. В результате электронная плотность на кольце понижена, и особенно в о- и п-положениях.

В итоге молекула бензальдегида плоская, все атомы углерода находятся в состоянии sp2-гибридизации, углы близки к 120.
При смещении электронной плотности с бензольного кольца происходит экранирование карбонильного атома углерода, и бензальдегид труднее вступает в характерные для альдегидов реакции нуклеофильного присоединения, чем алифатические альдегиды.
Таким образом, результатом такого распределения электронной плотности является уменьшение реакционной способности бензальдегида как по отношению к электрофилам в сравнении с бензолом, так и по отношению к нуклеофилам в сравнении с алифатическими аналогами.
10.8.3. Физические и химические свойства
Ароматические карбонильные соединения — это бесцветные жидкости или кристаллические вещества с приятным запахом.
Химические свойства прежде всего определяются наличием карбонильной группы (поэтому они должны быть аналогичны алифатическим альдегидам и кетонам) и бензольного кольца (как для любых замещённых бензолов). Однако возможны и специфические реакции.
Здесь не будут рассматриваться реакции, аналогичные алифатическим альдегидам и кетонам, такие как окисление, восстановление, замещение в алифатическом радикале (для жирно-ароматических кетонов), в том числе галоформная проба и некоторые из реакций нуклеофильного присоединения (гл. 6.1.4.1). Хотя, например, окисление ароматических альдегидов протекает очень легко даже кислородом воздуха на свету. Это объясняется образованием стабильного ароильного радикала

10.8.3.1. Нуклеофильное присоединение
Это типичные реакции всех альдегидов и кетонов. Ранее на примере алифатических аналогов (гл. 6.1.4.1) рассматривался этот тип реакций. Для ароматических карбонильных соединений также характерно присоединение воды, спиртов, синильной кислоты, гидросульфита натрия, аммиака и его производных, реактивов Гриньяра; по этому механизму протекают также рассмотренные ранее в алифатическом ряду реакции с гидридами металлов, пентахлоридом фосфора.
В целом ароматические альдегиды и кетоны менее реакционноспособны, чем их алифатические аналоги. Это объясняется двумя причинами: электронной и стерической. Первая причина связана со смещением электронной плотности с бензольного кольца на карбонильный атом углерода и уменьшением за счёт этого эффективного положительного заряда на этом атоме и электростатическим отталкиванием нуклеофильной частицы -электронной плотностью бензольного кольца. Вторая причина — это пространственные препятствия для подхода атакующей частицы к реакционному центру (карбонильному атому углерода). Уменьшение реакционной способности ароматических соединений по сравнению с алифатическими отразилось и на возможности протекания некоторых АdN-реакций. Так, если с гидросульфитом натрия взаимодействуют любые альдегиды и алифатические метилкетоны, то ароматические кетоны не присоединяют NaHSO3.


Аналогично формальдегиду (и некоторым другим алифатическим альдегидам) аренкарбальдегиды могут вступать в реакцию с фенолами и ароматическими аминами, как, например, рассмотрено в главах 10.5.3.3 и 10.6.3.1 на примере взаимодействия фенола и анилина с формальдегидом. Если субстратом считать фенол (или анилин), то механизм реакции SE, а по отношению к альдегиду механизм АdN.
Отсутствие -водородных атомов в молекулах ароматических альдегидов создаёт препятствия для протекания обычных в алифатическом ряду реакций альдольной и кротоновой конденсации. Поэтому такие реакции для аренкарбальдегидов будут возможны при участии их только в качестве субстрата (но не нуклеофила). Нуклеофилом может служить алифатический альдегид или кетон, жирно-ароматический кетон, эфир алифатической карбоновой кислоты или её ангидрид. При этом альдоль не образуется, а получаются сразу непредельные соединения (аналогичные продуктам кротоновой конденсации в алифатическом ряду). Например:

Взаимодействие ароматических альдегидов с ангидридами карбоновых кислот известно под названием конденсации Перкина*. Например:

Образование сразу непредельного продукта в этих случаях можно объяснить его устойчивостью за счёт наличия длинной сопряжённой системы с участием ароматического кольца. Такая сопряжённая система не может образоваться, если в реакцию вступает алифатический альдегид или кетон.
10.8.3.2. Диспропорционирование
Ранее на примере алифатических альдегидов рассматривались реакция Канниццаро и реакция Тищенко (гл. 6.1.4.3). В ароматическом ряду механизм и условия протекания этих реакций аналогичны алифатическим соединениям. В реакции Каниццаро все аренкарбальдегиды ввиду особенностей их строения (отсутствие -водородного атома) в присутствии щелочей превращаются в соль ароматической карбоновой кислоты и ароматический спирт.
![]()
В присутствии метаналя как более активного альдегида будет происходить восстановление аренкарбальдегида.
![]()
10.8.3.3. Электрофильное замещение
Ароматические карбонильные соединения будут вступать в реакции электрофильного замещения по бензольному кольцу. Однако для альдегидов и кетонов эти реакции протекают труднее, чем для незамещённого бензола и аренов, так как электронная плотность на кольце понижена за счёт –I- и –M-эффектов карбонильной группы. Это приводит к тому, что скорость реакций нитрования, сульфирования, галогенирования существенно ниже, чем для бензола, а реакции алкилирования, ацилирования, нитрозирования либо совсем не осуществляются, либо требуют для протекания особых условий.
Понижение электронной плотности за счёт –M-эффекта происходит в основном на атомах углерода о- и п-положений ароматического кольца (гл. 10.1.1), поэтому если реакция возможна, то протекает преимущественно в м-положение. Мета-ориентирующее действие карбонильной группы может быть объяснено также и динамическим подходом, то есть сравнением устойчивости образующихся -комплексов.
Примеры реакций электрофильного замещения в молекуле бензальдегида можно представить в виде следующей схемы:
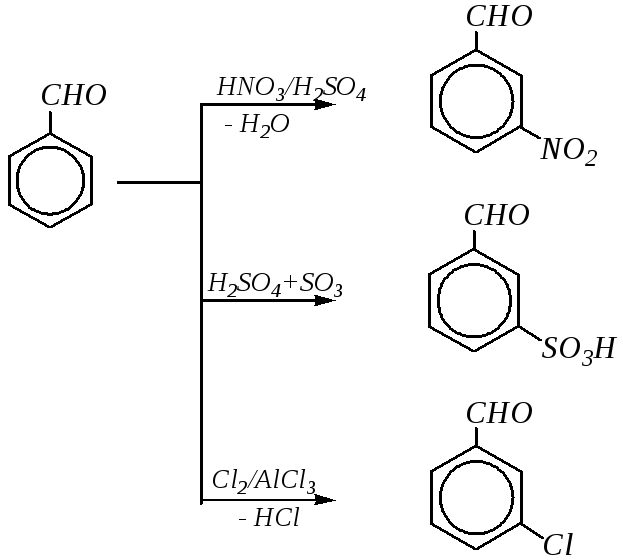
Вследствие лёгкой окисляемости альдегидной группы одновременно могут проходить и реакции окисления.
10.8.3.4. Специфические реакции
Бензоиновая конденсация. В эту реакцию вступают только ароматические альдегиды. Происходит конденсация двух молекул аренкарбальдегида при действии на него цианида калия (продукт реакции называется бензоином):

Реакция начинается как обычное нуклеофильное присоединение цианид-иона к альдегиду, но образующийся в результате такого присоединения анион перегруппировывается в более устойчивую структуру, в которой отрицательный заряд делокализован с участием и цианогруппы, и бензольного кольца:

Образовавшаяся частица, проявляя нуклеофильные свойства, необратимо взаимодействует со второй молекулой аренкарбальдегида, а дальнейшая перегруппировка и отщепление цианид-иона определяются образованием более устойчивых продуктов:


Расщепление диарилкетонов. Эта реакция протекает при действии на кетоны амидов щелочных металлов.

![]()
Продуктами реакции являются арен и амид аренкарбоновой кислоты (при подкислении).
Образование кетил-радикалов. Для бензофенона и некоторых его производных при присоединении атома водорода характерно образование стабильных радикалов. Например, в растворе изопропилового спирта при поглощении кванта света молекула бензофенона переходит в возбуждённое состояние вследствие перескока электрона с одного энергетического уровня на другой (со связывающих орбиталей на разрыхляющие). Бензофенон имеет долгоживущее (10-2с) возбуждённое состояние. Затем происходит отрыв водорода от молекулы растворителя с образованием кетил-радикала. Этот радикал отрывает ещё один атом водорода, давая бензгидрол, или димеризуется до бензпинакона:

10.8.4. способы получения
Среди способов получения ароматических карбонильных соединений наиболее важными являются те же способы, что и для получения алифатических альдегидов и кетонов (гл. 6.1.5).
Гидролиз ,-дигалогенаренов:

Способ пригоден для получения альдегидов, жирно-ароматических и чисто-ароматических кетонов.
Окисление первичных и вторичных спиртов протекает так же, как и для алифатических соединений (гл. 3.3.3.5).
Из хлорангидридов карбоновых кислот а) восстановлением, например, водородом на палладиевом катализаторе

б) кадмийорганическим синтезом (гл. 6.4.4.2)

Пиролиз карбоновых кислот или их кальциевых или бариевых солей.
Однако для ароматических карбонильных соединений существуют и другие способы получения.
Окисление аренов (арилметанов, диарилметанов, алкиларилметанов) кислородом в присутствии катализаторов или обычными неорганическими окислителями, например:
![]()
Формилирование и ацилирование аренов:

Это обычная реакция электрофильного замещения в ароматическое кольцо (реакция Фриделя–Крафтса), условия, механизм и особенности протекания которой рассмотрены в гл. 9.5.1. Формилирование может проводиться смесью монооксида углерода и хлороводорода (реакция Гаттермана–Коха):

10.8.5. Важнейшие представители
Бензальдегид — бесцветная жидкость с температурой кипения 453 К и запахом горького миндаля. Малорастворим в воде.
В промышленности бензальдегид получают из толуола (прямым окислением или хлорированием до бензилидендихлорида С6H5CHCl2 и последующим его гидролизом).
Используется в парфюмерной и пищевой (как вкусовое вещество) промышленности.
Ацетофенон С6H5COCH3 — бесцветное легкоплавкое вещество с температурой плавления 293 К и запахом черёмухи.
В промышленности ацетофенон получают из бензола ацетилированием или из этилбензола окислением.
Используется в парфюмерной промышленности.
Бензофенон С6H5COС6H5 — бесцветное кристаллическое вещество с температурой плавления 322 К.
В промышленности бензофенон получают окислением дифенилметана.
Используется в органическом синтезе и в качестве фотосенсибилизатора.



