
10 20 30 40 50
Температура ° C
3. Влияние рН.
Различная степень диссоциации белковых молекул при разных значениях рН, по-видимому, вследствие изменения свойств активного ж связывающего субстрат центров ферментной молекул приводит к их различной эффективности в зависимости от величины рН. Для каждого фермента существует оптимум рН, который может быть выражен более или менее отчетливо (рис.).
% 100

50 Каталаза ß-Фруктозидаза
Рис. 2
рН
3 4 5 6 7 8
|
Фермент |
рН |
Фермент |
рН |
|
Пепсин |
1,5-2,5 |
Каталаза |
6,8-7,0 |
|
ККаепсин В |
4,5-5,0 |
Уреаза |
7,0-7,2 |
|
ААмиза из солода |
4,9-5,2 |
Липаза панкреатическая |
7,0-8,5 |
|
Сахараза кишечная |
5,8-6,2 |
Трипсин |
7,5-8,5 |
|
Амилаза слюны |
6,8-7,0 |
Аргиназа |
9,5-10,0 |
Влияние концентрации субстрата.
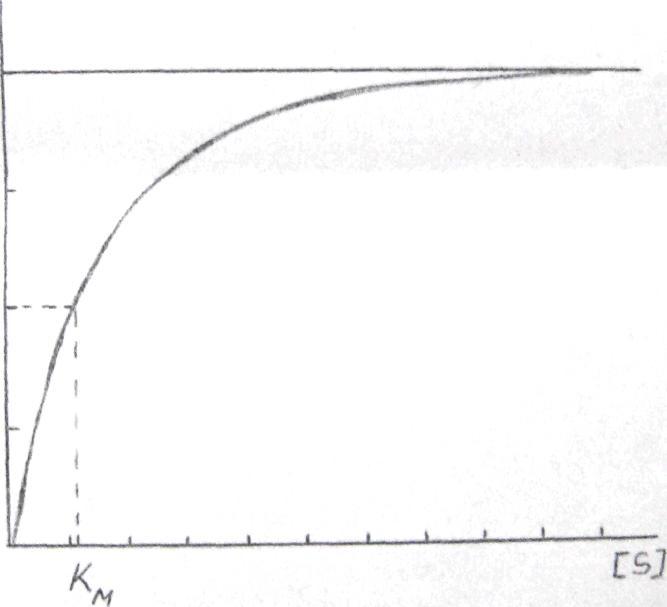
В 1913 Г. Михаэлис и Ментен выяснили, что скорооть реак-ции не пропорциональна концентрации субстрата. При увеличении концентрации субстрата скорость ферментативной реакции сначала увеличивается, а затем стремится к некоей постоянной величине. Кривая изменения скорости асимптоматически приближается к опре-деленному предельному значению, соответствующему максимальной скорости.
Субстрат S взаимодействует о ферментом E , образуя фермент-субстратный комплекс (ES ).
Vмакс.
![]()
V
Рис.4 Зависимость скорости реакции от концентраций субстрата - кривая Михаэлиса
Если инкубировать фермент поочередно с нарастающими концентрациями субстрата, то скорость реакции каждый раз будет увеличиваться; сначала очень бистро, затем медленнее и, наконец достигнет максимального значения, соответствующего максимальной скорости реакции (для данной концентрации фермента) - Vмакс.
Показано, что величина константы Михаэлиса - Кмдля V максданной реакции численно равна такой концентрации участвующего в ней субстрата, которая обеспечивает скорость реакции, равную половине максимальной. Для определения Км, ферментативную реакцию проводят при возрастающих концентрациях субстрата, каждый раз определяют начальные скорости реакции и строят соответствующую кривую. При помощи этой кривой определяют величину и берут значение, равное ее половине. Абсцисса той кривой, ордината которой равнаVмакс. /2, дает значение Кмакс.,которое, так же, как и концентрация, имеет размерность моль/л.
5. Влияние концентраций фермента
Ферментативные реакции протекают обычно в условиях избытка субстрата. В этих условиях скорость реакции пропорциональна количеству фермента, находящегося в среде. Эта пропорциональность сохраняется до определенного предела, за которым скорость снижается из-за недостатка субстрата (рис. ).
точки на
Vмакс.

. Время
Изменение
скорости реакции во времени
Как известно, скорость любой химической реакции уменьшается со временем (рис.).

Время
Однако, кривая хода ферментативных реакций во времени не имеет той общей формы, которая характерна для гомогенных химических реакций. Снижение скорости ферментативных реакций во времени может быть обусловлено угнетением продуктами реакции, уменъшением степени насыщения фермента субстратом (поскольку по мере протекания реакции концентрация субстрата снижается), частичной инактивацией фермента при заданной температур к рН среды. Учитывая обстоятельства, при исследовании скорости ферментативных реакций в тканях и биологических жидкостях обычно определяют начальную скорость реакции в условиях, когда скорость ферментативной реакции приближается к линейной.
7. Влияние активаторов и ингибиторов.
Химические соединения, влияющие на ход ферментативной реакции - эффекторы. Они могут быть активаторами или ингибиторами. Эффекторы представляют двоякий интерес. Во-первых, физиологический, так как некоторые из них играют важную роль в процессах регуляция метаболизма. Во-вторых, биохимический, поскольку позволяют получить важные сведения о природе действия ферментов. Существует много типов ферментативных эффекторов, различающихся по механизму их действия на фермента.
Активаторы- вещества, повышающие скорость реакции.
1) Активация ионами
Классическим примером активации ферментов ионами может служить активация ионами Мg++, которые необходимы для протекания реакций, связанных с переносом остатка фосфорной кислоты, в частности реакций, идущих с участием АДФ и АТФ. Часто бывает трудно установить, является ли данный ион коферментом, входящим как неотъемлемая часть в состав фермента, или же он выступает в качестве необходимого активатора. Ион может взаимодействовать с ферментом, во может действовать и на уровнесубстрата. В этом последнем случае во взаимодействие с ферментом вступает комплекс ион-субстрат. Так, например, с киназамивзаимодействует именно комплекс АТФ-Мg++. Многие ферменты
вообще не активны в отсутствие металлов. Так, при удалении Zn++ угольная ангидраза практически лишена ферментативной активности; более того, при действии этого фермента цинк неможет быть заменен никаким другим металлом. Известны ферменты, действие которых активируется рядом металлов, в частности, енолаза активируется Mn++, Mg++, К. В таблице приведены примерыучастия металлов в действии некоторых ферментов:
.
Металлы в активировании некоторых ферментов.
|
Фермент |
Металл |
Фермент |
Металл |
|
Цитохромы |
Fe |
Амилаза |
Ca |
|
Каталаза |
-“- |
Липаза |
-“- |
|
Пероксидаза |
-“- |
Карбоангидраза |
-“- |
|
Триптофаноксидаза |
-“- |
Лактатдегидрогеназа |
-“- |
|
Гомогентизиказа |
-“- |
Уриказа |
-“- |
|
Аскорбатоксидаза |
Cu |
Карбоксипептидаза |
-“- |
|
Тирозиназа |
-“- |
Пептидазы |
Mg |
|
Фенолоксидаза |
-“- |
Фосфатазы |
-“- |
|
Ксантиноксидаза |
Mo |
Фосфоглюкокиназа |
-“- |
|
Нитратредуктаза |
-“- |
Аргиназа |
Mn |
|
Альдегидоксидаза |
-“- |
Фосфоглюкомутаза |
-“- |
|
Пептидазы |
Co |
Холинэстераза |
-“- |
Относительно роли металлов в активирующем действии ферментов имеющиеся данные свидетельствуют о том, что в ряде случаев ионы металлов (Со2+,Mg2+,Fe2+) выполняют функции простетических групп ферментов. В других случаях они способствуют присоединению субстрата к активному центру и образованию фермент-субстратного комплекса. Например, ионыMg2+через отрицательно заряженную фосфатную группу обеспечивают присоединение монофосфорных эфиров органических веществ к активному центру фосфатаз, катализирующих гидролиз этих соединений. В ряде случаев металл соединяется с субстратом, образуя истинный субстрат, на который действует фермент. В частности ионыMg2+ активируют креатинфосфокиназу благодаря образованию истинного субстрата и магниевой соли АТФ. Наконец, имеются экспериментальные доказательства прямого участия металлов (например, ионов Са2+в молекуле амилазы слюны) в формировании и стабилизации активного центра и всей третичной структуры фермента.
3. Восстановители дисульфидов
SAH2 SH
E| ----------------E
SSH
неакт. акт.
4. Частичный протеолиз
НСL
Пепсиноген --------------пепсин
энтерокиназа
Трипсиноген-----------------------трипсин
5. Гормоны. Их посредник цАМФ.
Анионы при физиологических концентрациях обычно неэффективны или оказывают небольшое активирующее влияние на ферменты. Исключение составляют пепсин, некоторые оксидоредуктазы, активируемые анионами, а также слюнная амилаза, катализирующая гидролиз крахмала, активность которой повышается ионами хлора, аденилатциклаза, которая активируется анионами галогенов. Ингибиторами принято называть вещества, вызывающие частичное или полное торможение реакций, катализируемых ферментом. Поскольку ферменты являются белками, любые агенты, вызывающие денатурацию белка /нагревание, кислоты, щёлочи, соли тяжёлых металлов/ приводят к инактивации фермента. Однако такое инактивирование относительно неспецифично. Оно не связано с механизмом действия ферментов. Гораздо большую группу составляют так называемые специфические ингибиторы, которые оказывают своё действие на один какой-либо фермент или группу родственных ферментов. Исследование этих ингибиторов имеет важное значение по ряду причин.
Во-первых, ингибиторы могут дать ценную информацию о природе активного центра фермента, а также его функциональных групп, химических связей, обеспечивающих образование фермент-субстратного комплекса. Известны вещества, специфически связывающие ту или иную группу в молекуле фермента, выключая её из сферы химической реакции. В частности, йодацетат ICH2-COOH, его амид и этиловый эфир, парахлормеркурибензоатCIH-C6H4-COOHи другие реагенты сравнительно легко вступают в химическую связь с некоторымиSHгруппами ферментов. Если такие группы существенны для акта катализа, то добавление подобных ингибиторов приводит к полной потере активности фермента:
R+SH+JCH----HJ+R-S-CH2-COOH
Ряд других ферментов /холинэстераза, трипсин и химотрипсин/ сильно тормозится некоторыми фосфоорганическими соединениями, в частности дизопропилфторфосфатом /ДФФ/, вследствие блокирования ключевой гидроксильной группы серина в активном центре .
Во-вторых ингибиторы нашли широкое применение в энзимологии при исследовании природы множественных форм ферментов и изоферментов, отличующихся не столько по электрической подвижности, сколько по реакции на один и тот же ингибитор.
При помощи ингибиторов, избирательно выключающих отдельные стадии многоступенчатого метаболического процесса, могут быть могут быть точно установлены последовательность химических реакций и природа участвующих ферментов. В частности, этим путём при применении йодацетата, фторида и других ингибиторов был расшифрован гликолитический путь окислительно-восстановительных превращений глюкозы до молочной кислоты в мышечной ткани, насчитывающий 11 стадий с учачтием 11 ферментов и 10 промежуточных метаболитов.
На ингибировании ферментов основан механизм действия многих токсинов и ядов на организм.
Так, известно, что при отравлениях синильной кислотой смерть наступает вследствие полного торможения дыхательных ферментов /цитохромоксидазы/, в особенности клеток мозга. Токсическое влияние на организм человека и животных некоторых инсектицидов обусловлено торможением активности холинэстеразы – фермента, играющего первостепенную роль в деятельности нервной системы.
Рациональная химотерапия – осознанное применение лекарственных препартов в медицине, должна опираться на точное знание механизма их действия, на биосинтез ферментов или работу их в организме. Иногда метод лечения человека включает применение избирательных ингибиторов. Так ингибитор трипсина, химотрипсина и калликреина трасиол широко исползуется при лечении острого панкреатита. Избирательное ингибиторное действие на ферменты некоторых природных и синтетических соединений /так называемых антиметаболитов/ в настоящее время служит основой для разработки эффективных методов синтеза химотерапевтических препаратов. На этом пути открываются широкие возможности регуляции как синтеза ферментов, так и интенсивности метаболизма.
Типы ингибирования.Предлагается классификация ингибиторов.
И Специфические
(HCN) Неспецифические
(соли тяжёлых металлов) Аллостерические IVингибиторов в рез-те фосфат-модиф. Необратимого
действия (Диизопропил F-фосфат) Обратимого
действия Конкурентные
(малонат, сульфаниламиды, прозерин) Неконкурентные
(табун, зоман, зарин)





Несмотря на то что механизм действия большинства ингибиторов не выяснен, обычно различают обратимое и необратимое ингибирование. Если молекула ингибитора вызывает стойкие изменения или модификацию функциональных групп фермента, то такой тип ингибирования называется необратимым. Чаще, однако, имеет место обратимое ингибирование, поддающееся количественному изучению на основе уравнения Михаэлиса-Ментен. Обратимое ингибировании в свою очередь разделяют на конкурентное и неконкурентное, в зависимости от того, удается или не удается преодолеть торможение ферментативной реакции путем увеличения концентрации субстрата. Вовтором случае повышение концентрации субстрата не изменяет степень ингибирования фермента, Конкурентное ингибирование может быть вызвано веществами имеющими структуру, похожую на субстрат, но немного отличающуюсяот структуры истинного субстрата. Классическим примером подобного типа ингибирования является торможение активности сукцинатдегидрогеназы малоновой кислотой Этот фермент катализирует окисление путем дегидрировалия янтарной кислоты Если в среду добавить малоновую кислоту /ингибитор/, то в силу структурного сходства её с истинным субстратом янтарной кислотой /наличие двух таких же ионизированных карбоксильных групп/ она будет реагировать с активным центром с образованием фермент-ингибиторного комплекса /см. схему/, - однако при этом перенос водорода от малоната не происходит.Так как структуры субстрата- янтарной кислоты и ингибитора- малоната всё же несколько отличаются, они конкурируют за связывание с активным центром, и степень торможения будет определяться соотношением концентраций малоната и сукцината, а не абсолютной концентрацией малоната и сукцината, а не абсолютной концентрацией ингибитора. Этот тип ингибирования иногда называют ингибированием по типу метаболического антагонизма.
Метод конкурентного торможения нашёл широкое применение в медицинской практике. Известно, например, что для лечения некоторых инфекционных заболеваний, вызываемых бактериями, применяют сульфаниламидные препараты. Оказалось, что эти препараты имеют сходство с парааминобензойной кислотой, которую бактериальная клетка использует для синтеза фолиевой кислоты, являющейся составной частью ферментов бактерий. Благодаря этому структурному сходству сульфаниламид, например, блокирует действие фермента путем вытеснения парааминобензойной кислоты из комплекса с ферментом, синтезирующим фолиевую кислоту, что ведет к торможению роста бактерий.
Некоторые аналоги витамина В6и фолиевой кислоты, в частности дезоксипиридоксин и аминоптерин, действуют как конкурентные; так называемые коферментные ингибиторы (или антивитамины), тормозящие многие биохимические процессы в организме.
Неконкурентное ингибирование вызывается веществами, не имевшими структурного сходства с субстратами и часто связывающимися не с активным центром, а в другом месте молекулы фермента. Степень торможения во многих случаях определяется продолжительностью действия ингибитора на фермент.При данном типе ингибирования благодаря образованию активной ковалентной связи фермент часто подвергается полной инактивации, и тогда торможение становится необратимым. Примерами неконкурентного ингибирования (инактивации) является действие йодацетата, диизопропилфторфосфата, динитрофенилфосфата, синильной кислоты.
Регуляция активности ферментов


Быстрая Медленная Метаболическая Гормональная Профермент Гормональная Метаболическая





Аллостерическая

Изостерическая
Рассмотрим все эти типы регуляции.
Выше было указано, что одним ив уникальных свойств живых организмов является удивительна способность к сбалансированности катаболических (биодеградативных) и анаболических (биосинтетических процессов). Хотя в клетках одновременно совершаются процессы синтеза, распада и взаимопревращения сотен и тысяч разнообразных веществ, имеется множество регуляторных механизмов, обеспечивающих постоянство внутренней среды организма. Некоторые из этих регуляторных механизмов, среди которых важная роль принадлежит механизмам регуляции активности ферментов, будут рассмотрены ниже.
Влияние закона действия масс. В катализируемой ферментом обратимой химической реакции, например А + В ↔ С + Д, концентрация компонентов реакции и соответственно направление реакции будут регулироваться влиянием закона действия масс. Оно, в
частности, может быть показано в обратимой реакции трансаминирования, катализируемой аланинаминотрансферазой.
Аланин + α-кетоглутарат ↔ Пируват + глутамат
Этот тип регуляции играет, очевидно, лишь ограниченную роль, поскольку в реальных условиях реакция обычно протекает в одном направлении, так как образовавшиеся продукты могут оказаться субстратами для действия других ферментов и выводиться из сферы реакции; в этих случаях устанавливается скорее устойчивое (стационарное) состояние, чем истинное равновесие.
Изменение количества. фермента. У бактерий хорошо изучен феномен индуцированного синтеза ферментов при выращивании их на среде, где единственным источником углерода и энергии служит тот или иной углевод, допустим глюкоза. Замена, глюкозы в среде на . лактозу приводит к индуцированному ,или адаптированному (после небольшого периода лагфазы) синтезу фермента галактоидазы, расщепляющей лактозу на глюкозу и галактозу. В животных тканях подобный быстрый синтез ферментов наблюдается сравнительно реже, и механизм., индуцирующий синтез, изучен, только .для небольшого числа ферментов (тирозинтрансаминазы, серин- и. треаниндегидратазы, триптофанпирролазы и др. Однако при поступлении в организм некоторых ядов, канцерогенных веществ, алкалоидов, инсектицидов и др. наблюдается резкое увеличение через несколько дней активности /соответственно количества/ферментов – гидролаз гладкого эндоплазматического ретикулума клеток печени; окисляющих чужеродные вещества в нетоксичные для организма продукты. С другой стороны описаны случаи, когда под действием подобных гидроксилаз чужеродные вещества превращаются в организме в более токсичные соединения. Это явление, обратное детоксикации, получило название летального синтеза.
Проферменты. Протеолитические ферменты желудочно-кишечного тракта и поджелудочной железы синтезируются в неактивной форме, в виде проферментов /зимогенов/. Регуляция в в этих случаях сводится к превращению проферментов в активные ферменты под действем специфических агентов. Так трипсин синтезируется в поджелудочной железе в форме трипсиногена. Последний преврвщается в трипсин в кишечнике под действием другого белкового фермента – энтерокиназы, впервые открытого в лаборатории И.П.Павлова. Установлено, что активирующее действие энтерокиназы сводится к отщеплению от трипсиногена гксапептида, приводящему к формированию нативной третичной структуры трипсина и его активного центра; наблюдается также аутокатализ. Превращение неактивного пепсиногена в активный пепсин осуществляется аутокаталитически в результате ограниченного протеолиза в присутствии HCl и также связано с отщеплением от первого от первого специфического ингибитора полипептидной природы. Синтез протеиназ в неактивной форме и ряда других неактивных белков-предшественников имеет, очевидно, определённый биологический смысл, предотвращая разрушение клеток органов, в которых образуются проферменты.
Химическая модификация фермента. Выше было указано, что ряд белков при формировании третичной структуры подвергаются постсинтетической модификации. Оказалось, что ключевые ферменты энергетического обмена – фосфорилаза, гликогенсинтетаза и др. – также контролируются путём фосфорилирования и дефосфорилирования, осуществляемого специфическими ферментами – протеинкиназой и протеинфосфатазой, уровень активности которых в свою очередь регулируется гормонами. Уровень активности ключевых ферментов и соответственно интенсивность процессов обмена будут определяться соотношением фосфорилированных и дефосфорилированных форм этих ферментов.
Регуляция активности ферментов по принципу обратной связи. Во многих строго биосинтетических реакциях основным типом регуляции скорости многоступенчатого ферментативного процесса является ингибирование по принципу обратной связи, когда продукт биосинтетической цели подавляет активность фермента, катализирующего первую стадию.
Предположим, что в клетках осуществляется многоступенчатый биосинтетический процесс, каждая стадия которого катализируется собственным ферментом:
Е1 Е2 Е3 Е4
А

 --------X--------Б--------В--------Г--------
…Р
--------X--------Б--------В--------Г--------
…Р
Скорость подобной суммарной последовательности реакций в значительной степени определяется концентрацией конечного продукта (Р), накопление которого выше допустимого уровня оказывает мощное ингибирующее действие на первую стадию процесса, соответственно на фермент Е1.
Впервые существование подобного механизма контроля активности ферментов метаболитами было показано в Е.СоIпри исследовании синтеза изолейцина и цитидинтрифосфата (ЦТФ). Оказалось, что изолейцин, являющийся конечным продуктом, избирательно подавляет активность треониндегидратазы, катализирующей первое звено процесса превращения треонина в изолейцин, насчитывающего 5 ферментативных реакций. Аналогично ЦТФ как конечный продукт биосинтетического пути оказывает ингибирующий эффект на первый фермент (аспартаттранскарбомоилазу), регулируя тем самым свой собственный синтез. Этот тип ингибирования получил название ингибирования по принципу обратной связи или ретроингибирования. Существование его доказано во всех живых организмах: и в настоящее время он рассматривается как один из ведущих типов регуляции активности ферментов и клеточного метаболизма в целом.
Другие типы регуляции активности ферментов. Существует ряд других механизмов, контролирующих скорость метаболических процессов и активность внутриклеточных ферментов. К подобным механизмам могут быть отнесены конкуренция ферментов за общий субстрат, выключение активности одного из изоферментов (у множественных форм ферментов), влияние концентраций кофакторов и их формы (в особенности ионов металлов) и явление компартментализации. Механизм компартментализации играет, по-видимому, важную биологическую роль, пространственно разъединяя посредством биомембран ферменты от своих субстратов /например, лизосомальные ферменты: протеиназы, фосфатазы, рибонуклеазы и другие гидролитические ферменты, от веществ, на которые они действуют в цитоплазме/ или несовместимые в одно и то же время метаболические процессы. Примером последних могут быть пути синтеза жирных кислот, протекающие в основном в растворимой фракции циоплазмы, и пути распада жирных кислот, сосредоточенные в митохондриях.
