
7. Оксигеназный путь биологического окисления . Роль цитохрома р-450.
Почти во всех клетках около 90% всего потребляемого кислорода восстанавливается с участием цитохромоксидазы ( цитохрома аа3) митохондрий. Однако, в некоторых тканях содержатся ферменты иного типа, катализирующие особое окислительно-восстановительные реакции, в которых атомы кислорода включаются непосредственно в молекулу субстрата с образованием, например, новой гидроксильной или карбоксильной группы. Эти ферменты называются оксигеназами. Хотя в столь специализированных реакциях потребляется небольшая часть кислорода, однако, эти реакции очень важны для организма. Имеются два класса оксигеназ: диоксигеназы и монооксигеназы. Диоксигеназы катализируют реакции, в которых в молекулу субстрата включаются оба атома кислорода. Например, фермент пирокатехаза, катализирует реакцию окисления пирокатехина молекулярным кислородом, сопровождающуюся раскрытием кольца:
О

 ОН
ОН С- ОН
ОН
ОН С- ОН





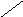

 +О
= О
+О
= О



 С - ОН
С - ОН
О
Моноксигеназы – катализируют реакции, в которых в молекулу органического субстрата включается толь один из атомов кислорода, а второй атом идет на образование воды. Монооксигеназам требуется два субстрата: главный субстрат, присоединяющий один атом кислорода, и косубстрат, поставляющий атомы водорода до воды ( Н20). Общее, управление для реакции, катализируемых моноогсигеназами, имеют вид:
А-Н + ВН2 + О=О А-ОН + В + Н2О-, гдеА-Н – главный субстрат, присоединяющий один атом кислорода ; ВН2 – косубстрат, донор атомов водорода для восстановления второго атома кислорода до Н2О. Поскольку в этих реациях главный субстрат гидроксилируется, эту группу ферментов называют гидроксилазами или оксигеназами.
Монооксигеназы могут использовать в качестве косубстрата восстановленные коферменты НАДФН2 или ФАДН2.
Наиболее многочисленны и особенно сложны монооксигеназые реакции, в которых участвуют цитохром Р-450, принадлежащий к группе гемопротеинов. Подобно митохондриальной цитохромоксидазе, цитохром Р-450 способен взаимодействовать с кислородом и с окисью углерода. Этот цитохром обычно содержится не в митохондриях , а в эндоплазматическом ретикулуме.
На рис 5 представлена схема микросомального окисления.
Н АДФН2 НАДФ+
АДФН2 НАДФ+


ФАДН» ФАД


2
 FеS+++
2FS++
FеS+++
2FS++

Цитохром Цитохром
Р
 -450
(Fe+++ ) Р-450 (Fe++)
-450
(Fe+++ ) Р-450 (Fe++)



 О2
О2
Цитохром Р-450++ - О Н2О
R-СН2ОН
R-СН3
Биологическая роль микросомального окисления исключительно велика : гидроскилирование стеройдных гормонов ; обезвреживание ряда лекарственных препаратов и других чужеродных для организма веществ, особенно если эти вещества сравнительно плохо растворимы в воде . Гидроксилирование чужеродных веществ( ксенобиотиков) способствет их дектоксикации и выведению их организма за счет коньюгирования в печени с « блоками» УДФГК или ФАФС.
8. Безферментный путь биологического окисления. Метаболизм супероксидрадикала.
Кислород является потенциально токсичным веществом . До недавнего времени его токсичность связывали с образованием в тнанях Н2О2. Однако, в последнее время в связи с открытием роли супероксидного анион – радикала и наличием у аэробных организмов супероксиддисмутазы, было выдвинуто предположение о том , что токсичность кислорода обусловлена его превращением в супероксид. Образование супероксида и пероксидного радикала:
О2 + е О2.-( супероксид).
О2 + Н+ НО2.( пероксидный радикал).
2О2.- + 2 Н+ ( супероксиддисмутаза) О2 +Н2О2
Н2О2 -----( безферментно)ОН+ + ОН-
О2.-; НО2.; Н2О2;ОН+ ” Свободные радикалы”
Эти радикалы способствуют перекисному окислению липидов мембран, накоплению МДФ ( малонового диальдегида), далее, окислению белков мембран и изменению функции клетки. Функцией СОД является защита аэробных организмов от повреждающего действия супероксида. Фермент представлен в нескольких формах: циотзольная СОД состоит из двух сходных субединиц, содержащихся по одному иону Cu+2 иZn+2; митохондриальный фермент содержит ионMn+2. Дисмутаза присутствует во всех тканях аэробов. Пребывание животных в атмосфере 100%-ного насыщения кислородом вызывает адаптивное повышение содержания
СОД, особенно в легких. Длительное пребывание организма в подобных условиях ведет к повреждению легких и летальному исходу. Антиоксиданты, например, витамин Е ( альфа- токоферол) способны улавливать свободные радикалы, снижая тем самым токсичность кислорода.
Заключение.
Метаболизм аэробных организмов полностью зависит от снабжения кислородом. Кислород используется ; главным образом , в процесе дыхания, которое сопряжено с окислительным фосфорилированием и накоплением энергии в макроэргических связях АТФ. Кроме того, молекулярный кислород включается в различные субстраты при участии ферментов называемых оксигеназами . Многие лекарства, посторонние для организма вещества и химические концерогены ( ксенобиокити) атакуются ферментами этого класса, которые получили название ферменты системы цитохрома Р-450.
Введением кислорода можно спасти жизнь больных, у которых нарушено дыхание или кровообращение. Однако, следует отметить, что интенсивная или продолжительная теропия кислородом может вызвать кислородное отравление.
Литература.
А. Ленинджер. Основы биохимии. Изд « Мир», Москва, 1985.
Р. Марри и соавт. Биохимия человека. Изд «Мир», Москва, 1993.
В.Л. Быков. Частная гистология человека. Сотис, С-Пб, 1997.
Медицинская лабораторная диагностика под ред. Профессора А.И. Карпищенко. С-Пб, интермедицина 1997.
