
- •Лекция 4 Окислительно-восстановительное титрование
- •4.1. Сущность метода
- •4.2. Классификация редокс-методов
- •4.3. Условия проведения окислительно-восстановительного титрования
- •4.4. Виды окислительно-восстановительного титрования
- •4.5. Индикаторы окислительно-восстановительного титрования
- •4.6. Графический метод изображения процесса окисления — восстановления
- •4.7 Перманганатометрическое титрование
- •4.8 Дихроматометрическое титрование
- •4.9 Иодиметрия, иодометрия
- •4.9.1 Иодиметрия
- •4.9.2 Иодометрия
4.5. Индикаторы окислительно-восстановительного титрования
Классификация индикаторов ОВ титрования.В титриметрических редокс-методах определяют КТТ индикаторным методом. При этом роль индикатора может играть либо сам реагент, участвующий в ОВ реакции, либо специально вводимый индикатор. В соответствии с этим индикаторы, применяемые в редоксметрии, можно классифицировать следующим образом.
Индикатор — реагент, участвующий в ОВ реакции.Примером может служить раствор титранта — перманганата калияKMnO4в перманганатометрии. Раствор перманганата калия обладает интенсивной малиново-фиолетовой окраской, поэтому первая же капля избыточного титранта после ТЭ окрашивает титруемый раствор в розово-малиновый цвет. Титрование оканчивают при появлении устойчивой розово-малиновой окраски раствора.
Индикатор — вещество, вступающее в специфическое взаимодействие с окислителем или восстановителем (участвующими в ОВ реакции) с образованием окрашенных соединений.
Примером может служить свежеприготовленныйраствор крахмала, который в присутствии иода окрашивается в синий цвет.
Другой пример — тиоцианат-ионы NCS‾, используемые в качестве индикатора при титровании железа(III), с которым они образуют комплексы, окрашенные в интенсивно-красный цвет. Так. при титровании железа(III) титрантом, содержащим титан(III), протекает реакция
Fe3+ +Ti3+=Fe2+ +Ti4+
В исходный титруемый раствор прибавляют тиоцианат аммония или калия, поэтому раствор имеет красный цвет за счет образования тиоцианатных комплексов железа(III). В процессе титрования железо(III) переходит в железо(II). В ТЭ железо(III) уже отсутствует, поэтому в ТЭ красная окраска раствора исчезает.
Индикатор — вещество, которое при определенном потенциале раствора окисляется или восстанавливается с изменением окраски. Такие индикаторы называют редокс-индикаторами, или окислительно-восстановительными индикаторами. Другими словами, редокс-индикаторы — это индикаторы, способные окисляться или восстанавливаться с изменением окраски в ТЭ или вблизи ее.
Окислительно-восстановительные индикаторы бывают о6ратимымиинеобратимыми.Обратимые индикаторы меняют окраску обратимо при потенциале раствора в ТЭ или вблизи ее и при этом не разрушаются. Необратимые индикаторы изменяют окраску при достижении определенного значения потенциала в ТЭ или вблизи ее и при этом необратимо разрушаются.
Обратимые редокс-индикаторы.Окисленная и восстановленная формы индикатора имеют различную окраску. Изменение цвета индикатора происходит при определенном значении потенциала раствора.
Полуреакцию, соответствующую изменению окраски редокс-индикатора, можно представить в виде
Indoх, +пе = Indred,
где Indoх,Indred— соответственно окисленная и восстановленная формы индикатора.
ОВ потенциал Ередокс-парыIndoхIndredописывается уравнением Нернста, которое для комнатной температуры можно представить в виде
-
Е = Еo+
0,059
lg
[Indox]
n
[Indred]
где E° ‑ стандартный ОВ потенциал данной редокс-пары.
Как и для кислотно-основных индикаторов, полагают, что при приблизительно одинаковой интенсивности окраски обеих форм индикатора человеческий глаз воспринимает окраску раствора той формой индикатора, концентрация которой примерно в 10 раз больше концентрации другой формы того же индикатора, т.е. при IndoхIndred= 10 раствор принимает окраску окисленной формы индикатора, а приIndoхIndred- 0,1 раствор окрашивается в цвет восстановленной формы индикатора. Следовательно, окраске окисленной формы индикатора соответствует потенциал раствора
-
Е Е°+
0,059
lg10 = E° +
0,059
n
n
а окраске восстановленной формы — потенциал раствора
-
Е ≤Е°+
0,059
lg0,1 = E° ‑
0,059
n
n
Объединяя оба эти выражения, получаем для интервала изменения окраски редокс-индикатора (интервала перехода) приближенно:
-
Е =Е°
0,059
n
т.е. окраска индикатора изменяется в пределах изменения потенциала раствора от Е°+ 0,059/n В доЕ°‑ 0,059/nВ. Наиболее резкое изменение окраски наблюдается при равенстве концентраций обеих форм, т.е. при значении потенциала раствора, равного
-
Е =Е°
0,059
lg 1 = Е°
n
Известно большое число обратимых редокс-индикаторов. В табл. 4.1 охарактеризованы в качестве примера некоторые ОВ индикаторы.
Одним из первых предложенных обратимых редокс-индикаторов является дифениламин С6Н5—NH—С6Н5.Полагают, что в присутствии окислителей дифениламин претерпевает в растворе превращения в соответствии с полуреакцией
|
2С6Н5—NH—С6Н5 С6Н5—NH—С6Н4‑С6Н4—NH—С6Н5+ 2Н++ 2е | ||
|
дифениламин бесцветный |
дифенилбензидин бесцветный |
|
Формулы выведены для случаев, когда в ОВ реакции не участвуют ионы водорода, а стехиометрические коэффициенты восстановленной и окисленной форм редокс-пар в соответствующих полуреакциях равны единице. В более сложных ситуациях логическая схема вывода формул для расчета индикаторных ошибок остается прежней, хотя сами расчеты становятся более громоздкими.
В практике фармацевтического анализа, когда индикаторная ошибка составляет сотые доли процента или еще меньше, ею обычно пренебрегают.
Считается возможным использование редокс-индикатора для фиксации КТТ тогда, когда индикаторная ошибка титрования с применением этого индикатора не превышает 0,1—0,2%.
Таблица 4.1.
Некоторые окислительно-восстановительные индикаторы
|
Индикатор |
Е°, В |
Цвет формы индикатора | |
|
окисленная |
восстановленная | ||
|
Нейтральный красный
|
-0,325 (рН 7) 0,240 (рН 0) |
красный |
бесцветный |
|
Индигокармин
|
-0,125 (рН 7) 0,291 (рН 0) |
синий |
» |
|
Метиленовая синяя |
0,011 (рН 7) 0,532 (рН 0) |
» |
» |
|
Толуиленовый синий |
0,115(рН7) 0,601 (pHO) |
» |
» |
|
Вариаминовый синий |
0,71 |
фиолетовый |
» |
|
Дифениламин |
0,76 |
» |
бесцветный |
|
Дифенилбензидин |
0,76 |
» |
» |
|
п-Этоксихризоидин |
0,76 |
бледно-желтый |
красный |
|
Дифениламин-4-сульфоновая кислота |
0,84 |
сине-фиолетовый |
бесцветный |
|
N-Фенилантраниловая кислота |
1,00 |
фиолетовый |
» |
|
Ферроин |
1,06 |
бледно-голубой |
красный |
|
Нитроферроин |
1,25 |
» |
» |
Эта стадия необратима. Образовавшийся бесцветный дифенилбензидин затем обратимо окисляется по схеме
|
С6Н5—NH—С6Н4‑С6Н4—NH—С6Н5⇆ |
|
дифенилбензидин бесцветный
|

дифенилдифенохинондиимин фиолетовый
с образованием окисленной окрашенной фиолетовой формы индикатора (В присутствии нитрат-ионов в кислой среде раствор окрашивается в синий цвет). Интервал перехода окраски индикатора изменяется в пределах Е =0,76± 0,0295 В.
Таким образом, собственно обратимым редокс-индикатором является не дифениламин, а дифенилбензидин, обратимо переходящий в дифенилдифено-хинондиимин.
К недостаткам дифениламина как редокс-индикатора относится его малая растворимость в воде (обычно готовят его 1%-ный раствор в концентрированной серной кислоте).
В качестве редокс-индикатора применяют также N-фенилантрониловую кислоту (2-дифениламинкарбоновую кислоту):
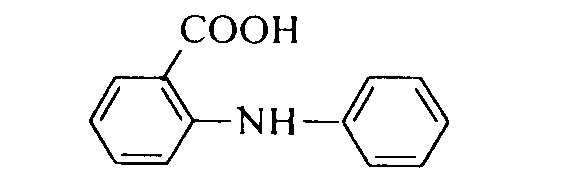
окисленная форма которой имеет фиолетово-красную окраску. Интервал (потенциал) перехода составляет Е= 1,00 ± 0,059 В. В отличие от дифениламинаN-фенилантраниловая кислота растворяется в воде, поэтому обычно готовят ее 0,2%-ный водный раствор или же 0,1%-ный раствор в 0,2%-ном растворе соды.
Индикатор ферроин представляет собой комплекс железа(II) с ортофенан-тролином состава [FеL3]2+, гдеL— молекула ортофенантролина (1,10-фенантролина)

Ферроин обратимо претерпевает окислительно-восстановительное превращение
[FеL3]3+ +е = [FеL3]2+
окисленная форма восстановленная форма
(бледно-голубая)(красная)
Интервал (потенциал) перехода составляет Е =1,06 В. Ферроин как редокс-индикатор обладает целым рядом достоинств: его растворы стабильны; окисленная форма индикатора устойчива по отношению к действию сильных окислителей; он проявляет резкое изменение окраски, которое осуществляется быстро и обратимо; допускает титрование при нагревании вплоть до ~60 °С.
Обычно раствор этого индикатора готовят, смешивая 1,624 г гидрохлорида фенантролина и 0,695 г FeSO4• 7Н2`О в 100 мл воды.
Необратимые ОВ индикаторы.К индикаторам этой группы относятся метиловый оранжевый, метиловый красный, нейтральный красный. При потенциале раствора, равном потенциалу, а в ТЭ, они необратимо окисляются, вследствие чего исчезает присущая им окраска раствора.
Другая классификация индикаторов ОВ титрования.Кроме рассмотренной выше предложена также следующая классификация индикаторов ОВ титрования:
1. Индикаторы группы соединений дифениламина и дифенилбензидина.
2. Индикаторы группы трифенилметановых и других красителей.
3. Хелатные комплексы дииминжелеза.
4. Индикаторы особого (специфического) действия.
5. Необратимые индикаторы, подвергающиеся деструкции.
6. Различные другие соединения.
7. Смешанные индикаторы.
