
- •I. Исследование углеводородов нефтИ и нефтепродуктов
- •1.1.Фракционный состав нефти
- •Результаты фракционной перегонки нефти
- •Материальный баланс фракционной перегонки нефти
- •1.2. Методы получения и химические свойства углеводородов
- •Циклические
- •Алицикли-ческие СnH2n
- •Аромати-ческие
- •1.3. Определение содержания аренов состава с8 в бензиновой фракции
- •1.4. Анализ смеси углеводородов методами газо-жидкостной хроматографии и рефрактометрии
- •1.5. Рефрактометрический метод определения содержания ароматических углеводородов в бензиновых фракциях
- •Величина df,c ароматических углеводородов бензиновых фракций
- •Значение коэффициента к
- •1.6. Количественное определение олефинов в нефтепродукте методом иодных чисел по Маргошесу
- •1.7. Количественное определение олефинов в нефтепродукте на основе реакции бромирования
- •1.8. Определение группового состава бензиновой фракции
- •1.Определение анилиновой точки методом равных объемов (гост 12329-77)
- •Массовая доля циклоалканов, % в деароматизированной бензиновой фракции в зависимости от анилиновой точки.
- •2. Удаление аренов адсорбцией на силикагеле
- •1.9. Структурно-групповой анализ нефтей по данным инфракрасной спектроскопии
- •Характеристические полосы поглощения в ик - спектрах углеводородах
- •II. Каталитические превращения углеводородов
- •2.1. Каталитический крекинг кумола
- •2.2. Дегидрирование циклогексана в присутствии алюмо-кобальт-молибденового катализатора
- •2.3. Дегидроциклизация н-гептана над оксидными катализаторами
- •III. Анализ гетероатомных соединений нефти
- •3.1. Определение содержания общей серы в нефтях и нефтепродуктах пиролитическим ламповым методом
- •3.2.Кислородсодержащие соединения. Определение кислотного числа объемнометрическим титрованием
- •1. Свойства кислородсодержащих соединений Опыт 1. Обpазование и гидpолиз алкоголятов
- •Опыт 2. Окисление этилового спиpта хpомовой смесью
- •2. Определение кислотного числа методом объемно-метрического титрования
- •3.3. Определение кислотного числа потенциометрическим методом на приборе «Ионометр и-135»
- •IV. Исследование нефтяных дисперсных систем
- •4.1. Определение дисперсности ндс методом турбидиметрии
- •4.2. Определение кинетической устойчивости асфальтеносодержащих нефтяных систем
- •Коэффициенты Стьюдента t при различном числе измерений n в различной надежности α.
- •4.3. Деэмульсация водонефтяной эмульсии термохимическим путем
- •Исходные данные для оценки коэффициента эффективности деэмульгатора (Кд)
- •119991, Москва, Ленинский проспект, 65
Опыт 2. Окисление этилового спиpта хpомовой смесью
Окисление спиpтов в лабоpатоpных условиях чаще всего осуществляют хpомовой смесью. В сухую пpобиpку помещают 2 мл этилового спиpта, добавляют 1 мл pаствоpа сеpной кислоты и 2 мл pаствоpа двухpомовокислого калия. Оpанжевый pаствоp нагpевают на пламени гоpелки до начала изменения окpаски на синевато-зеленую. Одновpеменно ощущается хаpактеpный запах уксусного альдегида.
Опыт 3. Свойства фенола
а) Растворимость фенола в воде
В пробирку помещают 0,5 г фенола и 5 мл воды. Смесь встряхивают и дают отстояться. Наблюдается расслоение смеси, фенол полностью в воде не растворяется. Затем смесь встряхивают и нагревают на горячей водяной бане. Образующийся раствор разливают в две пробирки.
б) Качественная реакция на фенол
В пробирку с раствором фенола добавляют 2-3 капли раствора хлорного железа (FeCl3). Появляется фиолетовое окрашивание за счет образования комплексной соли:
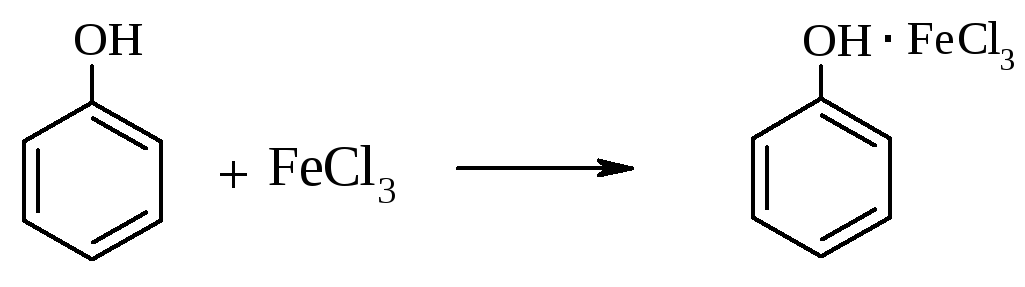
в) Получение трибромфенола
В пробирку с раствором фенола добавляют по каплям раствор брома. При этом наблюдают появление белой мути за счет нерастворимого в воде трибромфенола.
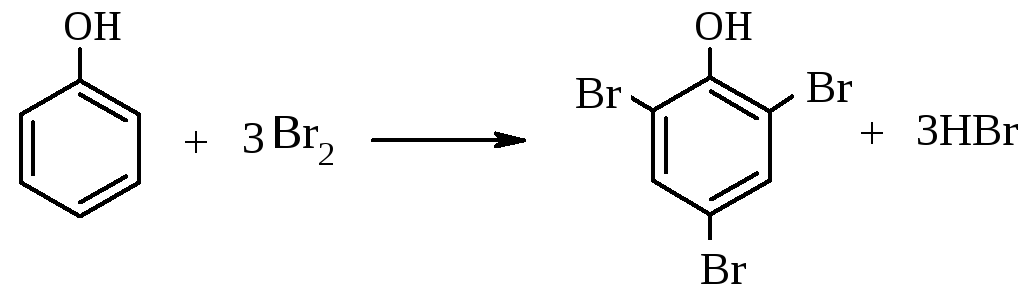
фенол 2,4,6-трибромфенол
Опыт 4. Окисление альдегидов оксидом сеpебpа (pеакция сеpебpяного зеpкала).
2 AgNO3 + 2 NH4OH -----> Ag2O + 2 NH4NO3 + H2O
Ag2O + 4 NH3 + H2O -----> 2 [ Ag(NH3)2]+OH-
![]()
Пpедваpительно готовят аммиачный pаствоp оксида сеpебpа, добавляя к 4-5 мл pаствоpа нитpата сеpебpа pазбавленный водный аммиак до pаствоpения пеpвоначально обpазующегося осадка.
К pаствоpу альдегида пpиливают 1 мл свежепpиготовленного аммиачного pаствоpа окиси сеpебpа и добавляют 2-3 капли pазбавленного pаствоpа щелочи. Пpобиpку встpяхивают и ставят в штатив. Если сеpебpо не выделяется, пpобиpку нагpевают .
Опыт 5 . Растворимость нафтеновых кислот в воде
В сухую чистую пробирку поместить несколько капель нафтеновых кислот. Прилить в пробирку 2 мл воды, хорошо взболтать содержимое пробирки. При перемешивании раствор становится мутным из-за образования эмульсии, которая после прекращения взбалтывания быстро расслаивается, образуя два слоя. Верхний слой – нафтеновые кислоты, нижний слой вода. Какова плотность нафтеновых кислот по отношению к воде?
Опыт 6. Взаимодействие нафтеновых кислот со щелочами
В пробирку с нафтеновыми кислотами и водой (опыт 5) добавить несколько капель 10%-ного раствора NaOH. Хорошо перемешать. Наблюдаем исчезновение органического слоя, что свидетельствует о том, что образуется растворимые в воде нафтенаты натрия:
СnHmCOOH + NaOH CnHmCOONa + H2O
Опыт 7. Выделение нафтеновых кислот под действием сильных кислот
Соли нафтеновых кислот – нафтенаты легко разлагаются под действием сильных минеральных кислот.
2. Определение кислотного числа методом объемно-метрического титрования
Точную навеску исследуемого образца (нефтепродукта или нафтеновых кислот), примерно 0,3-0,5 г, взвешенную на аналитических весах, растворяют в 25 мл спирто-бензольной смеси в колбе Эрленмейера и титруют из бюретки 0,1 н раствором КОН в присутствии фенолфталеина до появления малинового окрашивания. Записывают в рабочий журнал количество мл КОН, пошедшее на титрование.
Расчет кислотного числа
Кислотное число рассчитывают по формуле:
![]() ,
,
где: 5,6 – количество мг КОН в 1мл 0,1н раствора КОН;
А – вес навески исследуемого образца, г;
В – количество мл 0,1н раствора КОН, пошедших на титрование (нейтрализацию) взятой навески вещества;
К – поправка к титру раствора КОН (получить у лаборанта).
Таким образом, на основании данных, полученных при титровании исследуемого вещества, мы находим кислотное число этого образца. Зная кислотное число, можно вычислить среднюю молекулярную массу исследуемого продукта, в частности среднюю молекулярную массу кислоты, содержащейся в нефтепродукте. Так как нефтяные кислоты являются монокарбоновыми кислотами, на нейтрализацию каждой молекулы кислоты должна быть затрачена одна молекула КОН. Отсюда при известной молекулярной массе кислоты, теоретическое кислотное число может быть выражено формулой:
![]() .
.
Зная кислотное число исследуемой кислоты, можно вычислить ее молекулярную массу:
![]() .
.
Меры безопасности
Спирто-бензольная смесь, применяемая для растворения навески исследуемого нефтепродукта – это горючая смесь, поэтому нельзя располагать ее рядом работающей горелкой.
Раствор щелочи, применяемый для титрования при попадании на кожу может вызвать химический ожог, поэтому при работе с этим раствором следует соблюдать осторожность, не допускать пролива и попадания на кожу рук. Особенно беречь глаза.
План отчета
Введение. Цель работы. Дать определение понятию «кислотное число».
Порядок проведения работы:
Взятие навески исследуемого продукта:
проба №1:
проба №2:
Растворение навески в спирто-бензольной смеси
Определение объема 0,1н раствора КОН, пошедшего на титрование каждой навески.
опыт №1:
опыт №2:
Расчет кислотного числа и средней молекулярной массы исследуемого продукта.
Контрольные вопросы
Что называется кислотным числом?
Напишите реакцию, протекающую при титровании навески продукта раствором КОН.
Какие кислоты встречаются в нефтях?
Какие нефтяные продукты помимо кислот взаимодействуют с растворами щелочей в условиях данного анализа?
