
- •Лабораторный практикум по общей химии Издание третье, дополненное
- •Рецензенты д.Х.Н. Проф. Кафедры общей химии мгу им.. Ломоносова о. С. Зайцев и к.Х.Н. Доц. Кафедры промышленной экологии ргу нефти и газа г. И. Журавлев.
- •Введение
- •Порядок работы в химической лаборатории.
- •Лабораторная работа № 1. Важнейшие классы неорганических соединений
- •I. Разделы курса, необходимые для подготовки к лабораторной работе.
- •II. Вопросы и упражнения
- •III. Экспериментальная часть.
- •Лабораторная работа № 2 определение молярной массы эквивалента металла.
- •I. Разделы курса, необходимые для подготовки к лабораторной работе.
- •II. Вопросы и упражнения.
- •III. Экспериментальная часть. Определение молярной массы эквивалента магния.
- •Лабораторная работа № 3 приготовление растворов заданной концентрации
- •I. Разделы курса, необходимые для подготовки к лабораторной работе.
- •II. Вопросы и упражнения.
- •III. Экспериментальная часть
- •Опыт 1 Приготовление растворов солей из безводных веществ
- •Лабораторная работа № 4 химическая кинтика и химическое равновесие. Катализ
- •I. Разделы курса, необходимые для подготовки к лабораторной работе.
- •II. Вопросы и упражнения.
- •III. Экспериментальная часть.
- •Лабораторная работа № 5 электролитическая диссоциация.
- •I. Разделы курса, необходимые для подготовки к лабораторной работе.
- •II. Вопросы и упражнения.
- •III. Экспериментальная часть.
- •Лабораторная работа № 6 гидролиз
- •I. Разделы курса, необходимые для подготовки к лабораторной работе.
- •II . Вопросы и упражнения
- •III. Экспериментальная часть.
- •Лабораторная работа № 7 условия выпадения и растворния осадков
- •I. Разделы курса, необходимые для подготовки к лабораторной работе.
- •II. Вопросы и упражнения.
- •III. Экспериментальная часть.
- •Лабораторная работа № 8 комплексные соединения.
- •I. Разделы курса, необходимые для подготовки к лабораторной работе.
- •II Вопросы и упражнения.
- •III. Экспериментальная часть.
- •3А. Сульфат тетраамминмеди (II).
- •Ацидокомплексы.
- •4А. Тетраиодовисмутат калия.
- •4Б. Тетраиодомеркурат калия.
- •4В. Гидроксосоли.
- •Лабораторная работа № 9 окислительно-восстановительные реакции.
- •I. Разделы курса, необходимые для подготовки к лабораторной работе.
- •II. Вопросы и упражнения.
- •III. Экспериментальная часть. Межмолекулярные окислительно-восстановительные реакции
- •2А. Взаимодействие металлов с хлороводородной и разбавленной серной
- •2Б. Взаимодействие металлов с кислотами-окислителями. Взаимодействие меди и железа с концентрированной серной кислотой.
- •Взаимодействие меди и железа с разбавленной и концентрированной азотной кислотой.
- •2В. Взаимодействие амфотерного металла с раствором щелочи.
- •2Г. Взаимодействие металлов с растворами солей.
- •6А. Термическое разложение бихромата аммония.
- •6Б* Термическое разложение нитрата калия.
- •Лабораторная работа № 10 химические свойства металлов и их соединений
- •I. Разделы курса, необходимые для подготовки к лабораторной работе.
- •II. Вопросы и упражнения для подготовки к лабораторной работе.
- •III. Экспериментальная часть.
- •Жесткость воды
- •I. Разделы курса, необходимые для подготовки к лабораторной работе.
- •II. Вопросы и упражнения
- •III Экспериментальная часть
- •II. Вопросы и упражнения для подготовки к лабораторной работе.
- •III. Экспериментальная часть. Алюминий и его соединения
- •Металлы побочных подгрупп (d-металлы)
- •II. Вопросы и упражнения для подготовки к лабораторной работе.
- •III. Экспериментальная часть. Железо и его соединения
- •Цинк и его соединения
- •Медь и ее соединения
- •Лабораторная работа № 12 химические свойства неметаллов и их соединений
- •I. Разделы курса, необходимые для подготовки к лабораторной работе
- •Соединения углерода (IV)
- •II. Вопросы и упражнения
- •III. Экспериментальная часть.
- •Химические свойства соединений азота
- •II. Вопросы и упражнения.
- •III. Экспериментальная часть. Опыт 1.Свойства аммиака
- •Химические свойства пероксида водорода.
- •II. Вопросы и упражнения.
- •III. Экспериментальная часть.
- •Химические свойства серы и ее соединений
- •II. Вопросы и упражнения
- •III. Экспериментальая часть. Реакции s2-
- •Реакции s0
- •II. Вопросы и упражнения для подготовки к лабораторной работе.
- •Ш. Экспериментальная часть.
- •Лабораторная работа № 12 электродные потенциалы
- •I. Разделы теоретического курса для подготовки к лабораторной работе.
- •II. Вопросы и упражнения
- •III. Экспериментальная часть
- •IV. Вопросы и упражнения для защиты лабораторной работы
- •Лабораторная работа № 13 электрохимическая коррозия металлов.
- •I. Разделы курса, необходимые для подготовки к лабораторной работе.
- •II. Вопросы и упражнения.
- •III. Экспериментальная часть
- •3А) Пассивация железа в концентрированной азотной кислоте
- •3Б) Активация алюминия в растворе соляной кислоты
- •Оглавление
Лабораторная работа № 2 определение молярной массы эквивалента металла.
I. Разделы курса, необходимые для подготовки к лабораторной работе.
Понятие об относительной и абсолютной атомной и молекулярной массе. Понятия моль, молярная масса, молярный объём. Закон Авогадро и следствия из него. Нормальные условия. Приведение объёма газа к нормальным условиям. Объединённое уравнение Гей - Люссака и Бойля – Мариотта.
Понятие о валентности химического элемента.
Понятие об эквиваленте и молярной массы эквивалента простых и сложных веществ, участвующих в окислительно- восстановительной реакции. Объём моля эквивалента газообразного вещества (н.у.), участвующего в окислительно-восстановительном процессе.
Понятие об эквиваленте и молярной массе эквивалента сложного вещества, участвующего в ионно-обменной реакции. Влияние состава продуктов реакций ионного обмена на определение эквивалента и молярной массы эквивалента исходного вещества.
Закон эквивалентов. Математическое выражение закона эквивалентов для систем «твердое вещество (1) – твердое вещество (2)» «газ(1) – газ (2)», «твердое вещество – газ».
II. Вопросы и упражнения.
1. По каким формулам можно вычислить эквивалент и молярную массу эквивалента вещества, участвующего в ионно-обменных реакциях:
а) оксид алюминия + ….. сульфат алюминия + …
б) серная кислота + …... сульфат металла + …
в) гидроксид бария + ….. хлорид бария + …
г) сульфат хрома (III) + ….. хлорид хрома (III) + …
д) H3PO4 + … NaH2PO4 + …
е) Cr(OH)3 + … CrOHCl2 + …
2. По каким формулам можно вычислить эквивалент и молярную массу эквивалента вещества, участвующего в окислительно- восстановительных реакциях? Определите, чему равна молярная масса эквивалента метана СН4 и оксида углерода (II) в реакциях их полного сгорания (до оксида углерода (IV) и воды.
3. Рассчитайте молярную массу эквивалента железа в реакциях:
а) Fe + … FeCl2 + … б) Fe + … Fe(NO3)3 + …
4. Напишите формулы для расчета объёма моля эквивалента газообразного вещества и определите объём моля эквивалентов (н.у.) водорода, кислорода и азота в реакциях: N2 + О2 NH3 N2 + O2 NO
5. Какой объём водорода выделится при растворении 10г цинка в кислоте при н.у.?
6. Оксид трехвалентного металла содержит 47% (мас.) кислорода. Определите формулу оксида.
III. Экспериментальная часть. Определение молярной массы эквивалента магния.
Оборудование и материалы
Колбы на 250 и 500 мл; стакан на 300 мл; трубки стеклянные и каучуковые; зажим; резиновые пробки с отверстиями; фильтровальная бумага; калька; весы; мерный цилиндр на 100 мл; магниевая стружка; серная кислота разбавленная.
Порядок выполнения работы.
Работа выполняется обязательно двумя студентами!
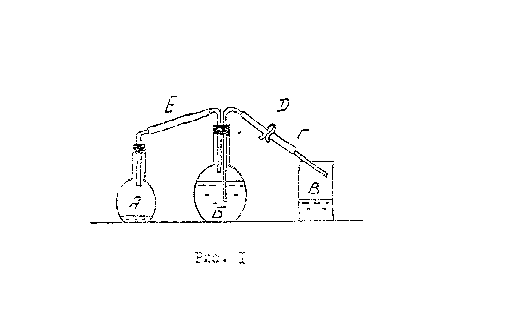
Для определения молярной массы эквивалента магния используется прибор, изображенный на рис. 1.
Прибор состоит из А- колбы объемом 250 мл, Б- колбы объёмом 500 мл, В- стакана объёмом 300 мл. Колба А снабжена резиновой пробкой с вставленной в нее короткой стеклянной трубкой, на которую надет резиновый шланг Е. Для колбы Б предназначена резиновая пробка с двумя вставленными в неё стеклянными трубками, на одну из которых надет резиновый шланг Е, а на другую- резиновый шланг с сифоном Г и зажимом Д.
а) Отмерьте цилиндром и вылейте в колбу А 25 мл разбавленной серной кислоты, стараясь избежать смачивания горла колбы. При попадании на него капель кислоты осторожно удалите их фильтровальной бумагой.
б) На кусочке кальки взвесьте на весах приблизительно 0,1 г магниевой стружки с точностью до 0,001 г.
в) Налейте в колбу Б водопроводной воды до начала горловины колбы.
г) Плотно заткните колбу Б пробкой с двумя трубками.
д) Заполните сифон Г водой, для чего наклоните колбу Б над раковиной в сторону трубки с сифоном и откройте зажим Д. Дайте воде вытеснить весь воздух из сифона и закройте зажим.
Убедитесь, что вода не капает из сифона и в него не попадают пузырьки воздуха. Если эти условия не выполняются, обратитесь за помощью к лаборанту.
е) Ополосните цилиндр водопроводной водой и отмерьте 50 мл воды (по нижнему краю мениска), вылейте воду в стакан В и опустите туда сифон.
ж) Наклоните горизонтально колбу А, не допуская попадания серной кислоты в горло колбы и осторожно поместите туда кальку с магниевой стружкой, не допуская попадания магния в кислоту.
з) Один из выполняющих работу фиксирует колбу Б, не допуская её падения и готовится открыть зажим Д. Второй, держа колбу А в горизонтальном положении, плотно закрывает её пробкой с отводной трубкой Е и ставит на стол, фиксируя руками обе колбы, чтобы избежать их падения. Первый студент одновременно с этим открывает зажим. Следите за тем, чтобы сифон был все время погружен в жидкость!
и) Если не весь магний попал в кислоту, необходимо, придерживая колбу Б, осторожно подвигать колбой А, добившись попадания в кислоту всего магния.
к) Дождитесь полного растворения магния в кислоте (прекращения выделения пузырьков водорода).
л) Фиксируя сифон погруженным в жидкость, уравняйте поверхность воды в колбе Б и стакане В, придвинув их друг к другу и осторожно приподняв стакан или колбу, в зависимости от того, где уровень воды выше. Добившись совпадения уровней жидкости, дайте команду закрыть зажим. Избегайте опрокидывания колбы А!
м) Объём воды, вытесненной из колбы Б в стакан В, равен объёму водорода, выделившемуся в колбе А при реакции магния с серной кислотой. Для определения объёма вытесненной воды следует вынуть сифон из стакана и перелить воду в мерный цилиндр. Если объём воды больше 100 мл, следует отмерить цилиндром 100 мл воды из стакана, вылить её в раковину и затем вылить в цилиндр остатки воды, определив её общий объём. Из полученной величины следует вычесть 50 мл, которые были налиты в стакан заранее. Запишите значение полученного объёма Vизмер. Если результат эксперимента не будет принят преподавателем, опыт следует повторить.
Обработка результатов эксперимента.(Расчетная часть).
Полученное значение объема водорода можно использовать для расчета массы эквивалента магния только после его приведения к нормальным условиям. При этом следует учитывать, что давление газов над водой в колбе Б, уравновешенное атмосферным давлением, определяется выделившимся водородом и парами воды: P = Pводор. + h
где
P- атмосферное давление, h- давление насыщенного водяного пара при температуре опыта.
Тогда
(P-h) Vизмер 273
V0=
760 (273+t)
где
V0- объём выделившегося водорода при нормальных условиях, мл.
P- атмосферное давление, мм. рт. ст., определенное по барометру.
h- давление насыщенного водяного пара, мм. рт. ст. при температуре опыта,
определенное по табл. 1
t - температура опыта, оС, определенная по термометру в лаборатории.
Таблица 1 Давление насыщенного водяного пара при различных температурах
|
t, оС |
P, мм.рт.ст |
t, оС |
P, мм.рт.ст |
t, оС |
P, мм.рт.ст |
t, оС |
P, мм.рт.ст. |
|
11 |
9,8 |
15 |
12,8 |
19 |
16,5 |
23 |
21,1 |
|
12 |
10,5 |
16 |
13,6 |
20 |
17,5 |
24 |
22,4 |
|
13 |
11,2 |
17 |
14,5 |
21 |
18,7 |
25 |
23,8 |
|
14 |
12 |
18 |
15,5 |
22 |
19,8 |
100 |
760 |
Поправка на давление водяных паров вводится в связи с тем, что
выделившийся водород в приборе контактирует с водой и общее давление,
вытесняющее воду из прибора складывается из парциальных давлений водорода и водяного пара.
Найденное значение V0 используется для расчета молярной массы эквивалента магния согласно закону эквивалентов по формуле:
m(Mg) V0(H2)
=
МЭ(Mg) VЭ(H2)
Где m(Mg)- масса магния, вступившего в реакцию;
MЭ(Mg)-молярная масса эквивалента магния;
V(H2)- выделившийся объём водорода (при н.у.);
VЭ(H2)- объем эквивалента водорода.
При расчете обратите внимание на единицы измерения используемых величин!
Вычислите относительную ошибку эксперимента (ε), принимая
теоретическое значение молярной массы эквивалента магния за 100%:
MЭ(Mg)(теор.) - MЭ(Mg)(эксп.)
ε= ·100%
MЭ(Mg) (теор.)
Укажите возможные источники ошибки при определении молярной массы эквивалента магния в ходе данной работы.
