
- •Глава 2 Важнейшие классы неорганических соединений
- •2.1. Разделы теоретического курса для повторения
- •2.2. Теоретическая часть.
- •2.2.1. Оксиды
- •Классификация оксидов.
- •Номенклатура оксидов
- •Графическое изображение формул оксидов
- •Физические свойства оксидов
- •Химические свойства оксидов
- •1. Основные оксиды взаимодействуют:
- •2. Кислотные оксиды взаимодействуют:
- •3. Амфотерные оксиды взаимодействуют:
- •2.2.2. Основания
- •Гидроксид натрия катион натрия гидроксид-ион
- •Графическое изображение формул оснований
- •Номенклатура оснований
- •Химические свойства оснований
- •3. Основания взаимодействуют с кислотными оксидами.
- •Амфотерные гидроксиды
- •Способы получения оснований
- •Области применения оснований
- •2.2.3. Кислоты
- •Классификация кислот
- •Многоосновные кислоты
- •Номенклатура кислот
- •Графическое изображение формул кислот
- •Физические свойства кислот
- •Химические свойства кислот
- •Способы получения кислот
- •Области применения кислот
- •2.2.4. Соли
- •Классификация солей
- •Номенклатура солей
- •Наиболее распространенных кислот
- •Графическое изображение формул солей
- •Физические свойства солей
- •Химические свойства солей
- •Способы получения солей
- •Применение солей
- •Генетическая связь между основными классами неорганических соединений
- •Типичный металл,
- •Названия некоторых бинарных соединений
- •2.3. Варианты тестированного контроля знаний
- •Вариант № 3
- •1) Барий, 2) цинк, 4) сера, 8) хром, 16) хлор.
- •1) Оксид натрия, 2) серная кислота, 4) вода, 8) соляная кислота, 16) гидроксид бария 32) гидроксид натрия.
- •1) Соляная кислота, 2) гидроксид калия, 4) оксид кремния (IV),
- •8) Серная кислота, 16) гидроксид бария, 32) вода.
- •1) Синий, 2) желтый, 3) бесцветный, 4) малиновый?
- •1) Синий, 2) желтый, 3) бесцветный, 4) малиновый?
- •1) Синий, 2) желтый, 3) бесцветный, 4) малиновый?
- •1) Добавить раствор хлорида натрия, 2) добавить раствор соляной кислоты, 4) добавить раствор гидроксида калия
- •8) Добавить раствор азотной кислоты?
- •1) Гашеная известь, 2) негашеная известь, 3) натронная известь, 4) каустик, 5) едкий натр.
- •1) Цинк, 2) медь, 4) натрий, 8) серебро, 16) алюминий, 32) золото?
- •1) HBr, 2) hClO4, 4) h2so4 (разбавл.), 8) ch3cooh,
- •16) Hno3 (разбавл.), 32) h2so4 (концентр.).
- •1) Азотная кислота, 2) хлорная кислота, 3) хлорноватая кислота,
- •4) Хлорноватистая кислота, 5) серная кислота?
- •1) Koh (раствор), 2) NaOh (расплав),
- •4) BaO тв. (при нагревании), 8) н2so4, 16) Al2o3.
- •1)Раствор перманганата калия, 2) раствор соляной кислоты,
- •3) Раствор хлорида бария, 4) раствор аммиака,
- •5) Раствор гидроксида натрия?
- •1) Цинк и магний, 2) медь и цинк, 4) железо и медь,
- •8) Ртуть и серебро, 16) натрий и никель.
- •2.5. Ответы на вопросы тестированного контроля знаний по теме « Основные классы неорганических соединений» Вариант № 1
- •Вариант № 2
- •Вариант № 3
2.2.3. Кислоты
Кислотами называются сложные вещества, распадающиеся в водном растворе (или расплаве) на положительно заряженные ионы водорода и отрицательно заряженные ионы кислотного остатка (определение Аррениуса).
Например:
HCl H+ + Cl
хлороводородная кислота ион водорода кислотный остаток
Н2SO4 2Н+ + SO4 2-
серная кислота ионы водорода кислотный остаток
Классификация кислот
1. Все кислоты по основности можно подразделить на одноосновные и многоосновные.
Основность кислот определяется количеством атомов водорода в молекуле кислоты, которые могут замещаться на атомы металлов с образованием соли.
Одноосновные кислоты
Например:
HCI – хлороводородная (соляная кислота),
НJ – йодоводородная кислота,
HBr – бромоводородная кислота,
НNО3 – азотная кислота,
НСN – циановодородная (синильная) кислота,
HPO3 – метафосфорная кислота,
HNO2 – азотистая кислота и др.
Многоосновные кислоты
а) двухосновные:
например:
Н2S – сероводородная кислота,
H2SO4 – серная кислота,
Н2SО3 – сернистая кислота,
Н2СО3 – угольная кислота,
H3PO3 (H2HPO3) – фосфористая кислота.
в) трехосновные:
например:
H3PO4 – ортофосфорная кислота,
H3AsO4 – ортомышьяковая кислота и др.
2. По наличию в составе молекулы кислоты кислорода все кислоты подразделяются на бескислородные и кислородсодержащие (оксокислоты).
Бескислородные кислоты (как говорит само название) не содержат в своем составе кислорода.
Кислородсодержащие кислоты представляют собой гидраты кислотных оксидов (ангидридов кислот):
SO2 + Н2О = Н2SО3 – сернистая кислота,
CO2 + H2O = H2CO3 – угольная кислота,
Р2О5 + 3Н2О = 2Н3РО4 – ортофосфорная кислота.
Некоторые кислотные оксиды непосредственно с водой не взаимодействуют, но соответствующие им гидраты, полученные другим способом, представляют собой кислородсодержащие кислоты.
Например:
S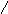 iO2
+ H2O
→
iO2
+ H2O
→
Данная реакция не идет, но в качестве гидрата оксиду кремния (IV) соответствует кремниевая кислота H2SiO3, которую можно получить косвенным путем.
3. В зависимости от количества молекул воды, присоединенных одной молекулой кислотного оксида (ангидрида), кислородсодержащие кислоты можно подразделить на мета-, пиро- и орто - формы.
Например:
Р2О5 + Н2О = 2НРО3 – метафосфорная кислота,
P2O5 + 2H2O = H4P2O7 – пирофосфорная кислота,
Р2О5 + ЗН2О = 2Н3РО4 ортофосфорная кислота.
Если кислота имеет две формы, то менее богатая водой форма –это метаформа кислоты, более богатая водой форма ортоформа кислоты.
Например:
НВО2 – метаборная кислота,
Н3ВО3 – ортоборная кислота,
НА1O2 – метаалюминиевая кислота,
H3AlO3 – ортоалюминиевая кислота и др.
Номенклатура кислот
Водные растворы галогеноводородов, а также водородных соединений серы, селена, теллура и некоторые другие рассматривают как бескислородные кислоты.
Названия бескислородных кислот образуются от названия неметалла с прибавлением слова водородная:
Например:
HF – фтороводородная кислота
НС1 – хлороводородная кислота
НВr – бромоводородная кислота
HJ – йодоводородная кислота
НСN – циановодородная кислота
НСNS – родановодородная кислота
Традиционные названия кислородсодержащих кислот образуются в зависимости от названия элемента, образующего кислоту (кислотообразующего элемента), с учетом степени его окисления. Если кислотообразующий элемент имеет высшую (совпадающую с номером группы в периодической системе элементов) или любую единственную степень окисления, то название кислоты складывается из названия элемента с добавлением следующих суффиксов: -н-, -ов- или -ев-.
Например:
H2S+6O4 – серная кислота,
НМn+7О4 – марганцовая кислота,
H2Ge+4O3 – германиевая кислота.
Традиционные названия кислородсодержащих кислот представлены в табл. 2.1.
Таблица 2.1
Традиционные названия некоторых кислородсодержащих кислот
|
Формула |
Название |
|
H3AsO4 |
Ортомышьяковая кислота |
|
H3AsO3 |
Ортомышьяковистая кислота |
|
HAsO3 |
Метамышьяковая кислота |
|
H3BO3 |
Ортоборная кислота |
|
НВО2 |
Метаборная кислота |
|
НВrO4 |
Бромная кислота |
|
HBrO3 |
Бромноватая кислота |
|
НВrО |
Бромноватистая кислота |
|
Н2CO3 |
Угольная кислота |
|
HClO4 |
Хлорная кислота |
|
HClO3 |
Хлорноватая кислота |
|
HClO2 |
Хлористая кислота |
|
НС1O |
Хлорноватистая кислота |
|
НМnО4 |
Марганцовая кислота |
|
Н2МnО4 |
Марганцовистая кислота |
|
НNO3 |
Азотная кислота |
|
НNO2 |
Азотистая кислота |
|
H3PO4 |
Фосфорная кислота |
|
Н3PО3 |
Ортофосфористая кислота |
|
Н4P2O7 |
Дифосфорная (пирофосфорная) кислота |
|
H2SO4 |
Серная кислота |
|
H2S2O7 |
Дисерная кислота |
|
H2SO3 |
Сернистая кислота |
|
H2SiO3 |
Кремниевая кислота |
|
H2CrO4 |
Хромовая кислота |
|
H2Cr2O7 |
Двухромовая кислота |
|
CH3COOH |
Уксусная кислота |
