
- •Кафедра «Моделирование систем и информационные технологии»
- •Москва 2005
- •Введение
- •Электродные потенциалы
- •2. Гальванические элементы
- •3. Электролиз. Различие гальванического элемента и электролизера
- •4. Электролиз в водном растворе
- •5. Экспериментальная часть
- •5.1. Сравнение химической активности различных металлов
- •5.2. Гальванический элемент. Электролизер
- •Поместить в 2 пробирки по грануле металла
- •Литература
4. Электролиз в водном растворе
При электролизе водных растворов электролитов в электродных полупроцессах может принимать участие, кроме электролита, вода. В результате электролитического разложения воды на катоде образуется водород, а на аноде – кислород.
Поскольку вода – слабый электролит, в ионных уравнениях записывают не ее ионы, а молекулы. Именно молекулы (а не большие количества ионов Н+и ОН-) в основном участвуют в полупроцессах на электродах:
восстановление на катоде 2Н2O + 2e-= Н2+ 2ОН-;
окисление на аноде 2Н2O - 4e-= О2+ 4Н+.
Из этих полуреакций также следует, что у катода возрастает концентрация ионов ОН-, а у анода – Н+(Н3О+), а так как одновременное увеличение обеих концентраций в воде невозможно (при 250С КН2O =Н+ОН-= 110-14), то эти ионы объединяются в молекулы Н2O. Отсюда суммарное уравнение электролиза воды:
электролиз
2Н2O -------2Н2 + О2.
При электролизе водных растворов электролитов в катодном восстановлении и анодном окислении в принципе могут участвовать ионы воды (Н+ и ОН-) и ионы электролита. Одноименные по знаку ионы воды и электролита конкурируют между собой, и разряжаться будет тот катион (на катоде) и тот анион (на аноде), которому отвечает более низкое по значению напряжение разряда.
Для распространенных катионов имеется следующий ряд разряжаемости на катоде:
наиболее неблагородные менее неблагородные благородные
металлы металлы металлы
K+ Na+ Mg2+ Al3+ H+ Zn2+ Fe2+ Ni2+ Sn2+ Pb2+ Cu2+ Ag+
Трудно разряжаемые --------------------------------------------- легко разряжаемые
Продукты электролиза в водном растворе:
только Н2 металл и Н2 только металл
Для распространенных анионов имеется следующий ряд разряжаемости на аноде:
кислородосодержащие
кислотные остатки OH- Cl- Br- I-
(SO42- NO3- и т.п.)
Трудно разряжаемые --------------------------------------------- легко разряжаемые
С помощью этих рядов легко определить, какими будут продукты электролиза для водных растворов различных электролитов.
5. Экспериментальная часть
5.1. Сравнение химической активности различных металлов
Опыт
1. ![]()
![]()
Опыт
2. ![]()
![]()
Опыт
3. ![]()
![]()
Опыт
4. ![]()
Выводы. 1. Металлы, стоящие в ряду активности до водорода вытесняют его из разбавленных кислот. Медь стоит в ряду активности после водорода, поэтому не растворяется в разбавленных кислотах.
2. Из рассмотренных металлов более активный Mn, так как он имеет более отрицательный электродный потенциал, а поэтому растворяется в кислоте лучше, чем другие рассмотренные металлы.
3. Металлы, имеющие меньший электродный потенциал, вытесняются из растворов металлами с большим электродным потенциалом.
5.2. Гальванический элемент. Электролизер
 Опыт
1. При введении
медной проволоки в раствор
до
Опыт
1. При введении
медной проволоки в раствор
до
прикосновения с поверхностью цинка наблюдаем бурное выделение пузырьков водорода вдоль медной проволоки. Возник гальванический элемент Zn/Cu. Скорость реакции усилилась (Рис. 4).
Анод (-) Катод (+)
![]()
![]()
Zn
+ 2H![]() =
Zn
=
Zn![]() +
H
+
H![]()
Рис.4.
Вывод: ускорение реакции растворение цинка вызвано возникновением гальванического элемента Zn/Cu.
Опыт
2. При введении
в раствор серной кислоты нескольких
капель медного купороса
![]() наблюдается
выделение пузырьков газа с поверхности
металла (цинка).
наблюдается
выделение пузырьков газа с поверхности
металла (цинка).
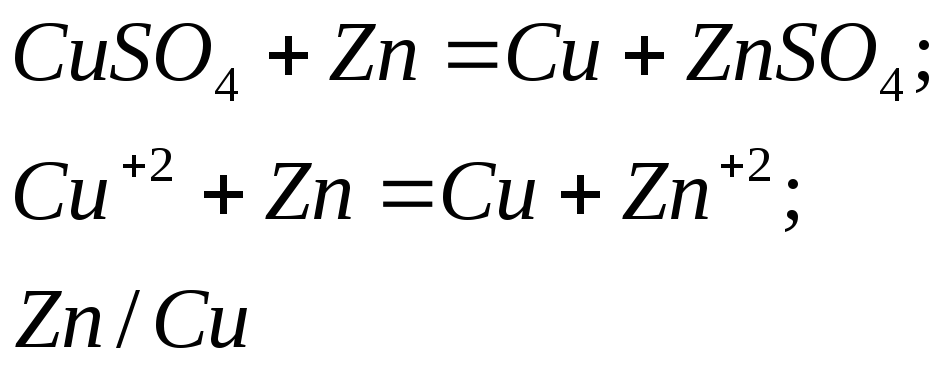

Вывод: ускорение реакции растворения цинка вызвано возникновением множества микрогальванических элементов на поверхности металла цинка.
Рис.5.
Опыт 3. Ионы, разрушающие защитные пленки металлов и тем самым способствующие коррозии металлов, называются активаторами коррозии.
