
- •Кафедра «Моделирование систем и информационные технологии»
- •Москва 2005
- •Введение
- •Электродные потенциалы
- •2. Гальванические элементы
- •3. Электролиз. Различие гальванического элемента и электролизера
- •4. Электролиз в водном растворе
- •5. Экспериментальная часть
- •5.1. Сравнение химической активности различных металлов
- •5.2. Гальванический элемент. Электролизер
- •Поместить в 2 пробирки по грануле металла
- •Литература
ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ОБРАЗОВАНИЮ
Государственное образовательное учреждение высшего
профессионального образования
"МАТИ" Российский государственный технологический университет
имени К.Э. Циолковского
_______________________________________________________________
Кафедра «Моделирование систем и информационные технологии»
ЭЛЕКТРОХИМИЯ
Методические указания к лабораторным работам по курсу «ХИМИЯ»
СОСТАВИТЕЛИ: БЕЛОВА С.Б
ГРИШИНА Н.Д.
ГОРЛАЧЕВА Т.К.
Москва 2005
Цель работы:приобретение теоретических и экспериментальных знаний о работе гальванических элементов и электролизных ячеек и навыков составления уравнений реакций, лежащих в основе электрохимических процессов.
Введение
Электрохимия – область химии, которая изучает реакции, дающие электрический ток или протекающие под его действием.
Такие реакции называются электрохимическими. При электрохимических реакциях происходит превращение химических видов энергии в электрическую и, наоборот, электрической энергии в химическую. Устройство, в котором происходит превращение химической энергии окислительно-восстановительной реакции в электрическую, называют гальваническим элементом. Устройство, в котором происходит преобразование электрической энергии в химическую, называют электролизером.
Электродные потенциалы
Химический характер какого-либо металла в значительной степени обусловлен тем, насколько легко он окисляется, т.е. насколько легко его атомы могут переходить в состояние положительных ионов:
М0 – ne- Mn+.
Металлы, которые окисляются легко, называются неблагородными (Li, K, Ba, Ca, Na, Mg, Al, Mn, Cr, Zn, Fe). Металлы, которые окисляются с большим трудом, называются благородными (Cu, Ag, Pt, Au).
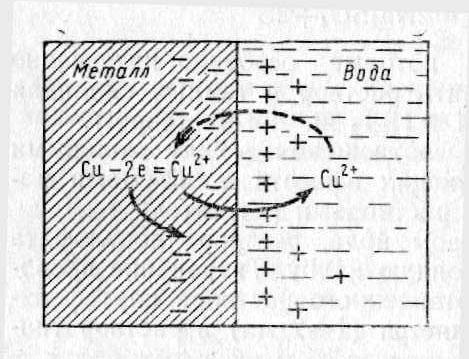 Если
металлическую пластинку, например
медную, погрузить в водный раствор его
собственной соли (Cu),
то из слоя металла, находящегося на
границе с водой, положительно заряженные
ионы Cu2+
начнут переходить в воду (рис. 1).
Если
металлическую пластинку, например
медную, погрузить в водный раствор его
собственной соли (Cu),
то из слоя металла, находящегося на
границе с водой, положительно заряженные
ионы Cu2+
начнут переходить в воду (рис. 1).
Рис.
1. Схема процесса, протекающего на
границе раздела металл-вода
Равновесие между ионами в растворе и металлом для приведенного примера выражается уравнением:
Cu2+(р-р) + 2e- = Cu (к) .
При контакте металла с раствором его соли эти две соприкасающиеся фазы (твердая/жидкая) приобретают противоположные заряды. В результате на поверхности раздела фаз (металл/водный раствор его соли) образуется двойной электрический слой, и между металлом и раствором возникает разность электрических потенциалов.
Подобная система – металл, погруженный в раствор электролита, – называется электродом.
Электроды – это система, состоящая из электрического проводника и раствора (или расплава) электролита, в который погружен проводник. Пример типичного электрода: медная пластина в водном растворе CuSO4 (обозначается Cu2+/ Cu). Устройство, состоящее из двух электродов, называется гальваническим элементом.
Состояние равновесия электродного процесса определяется электродным потенциалом Е, представляющим собой разность потенциалов на границе металл/электролит. Непосредственно измерить абсолютное значение разности потенциалов на границе металл/электролит невозможно, так как она возникает между двумя фазами разной природы (твердый металл – жидкий раствор). Однако можно измерить разность потенциалов двух химически разных электродов, приняв один из них за электрод сравнения. В качестве электрода сравнения применяют водородный электрод H+/ H2(г), на котором устанавливается равновесие:
H+(р-р) + e- = 1/2H2(г).
Сравнение значений разности потенциалов различных электродов проводят в стандартных условиях: при температуре250С(298,15 К), давлении101,3 кПа(1 атм), концентрации (активности) ионов1 моль/л. В электроде сравнения, называемомстандартный водородный электрод, поддерживается концентрация катионов водорода 1 моль/л и давление газообразного водородаH2101,3 кПа(1 атм).
Разность потенциалов стандартного водородного электрода и какого-либо другого электрода (металл/раствор соли металла), измеренная при стандартных условиях, называется стандартным электродным потенциалом (обозначается Е0).
Стандартный потенциал стандартного водородного электрода условно принят равным нулю.
Разность электродных потенциалов Е0 – этоэлектродвижущая сила(ЭДС) гальванического элемента. Так как водородный электрод служит электродом сравнения, для которого Е0 = 0 В, то измеряемая ЭДС рассматриваемого элемента – это потенциал измеряемого электрода по отношению к водородному. Таким образом, потенциалы металлов можно сравнивать по ЭДС гальванической цепи с водородным электродом.
Стандартные потенциалы Е0распространенных металлов Мn+/M0всегда относятся к определенному электродному процессу, т.е. к определенному заряду и составу катиона металла в растворе. Так, для железа это могут быть катионыFe2+ иFe3+.
В зависимости от того, положительноилиотрицательнозаряженным оказывается металлический электрод относительно стандартного водородного электрода, стандартный потенциал пары Мn+/M0также может иметьположительное илиотрицательноезначение.
Пример. Длямедноводородного гальванического элемента, состоящего из медногоCu2+/Cu0и водородногоH+/H02 электродов, в стандартных условиях разность потенциалов составляет +0,338 В. Медный электрод является положительным полюсом гальванического элемента, а водородный электрод – отрицательным полюсом. Следовательно, стандартный потенциал парыCu2+/Cu0будет иметь такое же значение (по абсолютному числовому значению и знаку):
Cu2++ 2e-=Cu0 ; Е0 = +0,34 В.
Для цинководородного гальванического элемента, состоящего из цинковогоZn2+/Zn0и водородногоH+/H02 электродов, в стандартных условиях разность потенциалов составляет –0,763 В. Цинковый электрод является отрицательным полюсом гальванического элемента, а водородный электрод – положительным полюсом. Следовательно, стандартный потенциал парыZn2+/Zn0будет иметь такое же значение (по абсолютному числовому значению и знаку):
Zn2++ 2e-=Zn0 ; Е0 = -0,76 В.
Если расположить стандартные электродные потенциалы металлов в порядке уменьшения их отрицательного значения и повышения положительного, то получится ряд стандартных электродных потенциалов:
|
Равновесная электродная реакция |
Е0, В |
|
Li+ + e- = Li |
-3,05 |
|
Na+ + e- = Na |
-2,71 |
|
Zn2+ + 2e- = Zn |
-0,76 |
|
Fe2+ + 2e- = Fe |
-0,44 |
|
H+ (110-7моль/л)+ e- = 1/2 H2 |
-0,41 |
|
Sn2+ + 2e- = Sn |
-0,14 |
|
H+ (1моль/л) + e- = 1/2 H2 |
0,00 |
|
Cu2+ + 2e- = Cu |
+0,34 |
|
Ag+ + e- = Ag |
+0,80 |
|
Au3+ + 3e- = Au |
+1,50 |
Чем более отрицателен электродный потенциал, тем выше способность металла посылать ионы в раствор и тем сильнее проявляет себя металл как восстановитель.
Все металлы, расположенные выше водорода, т.е. имеющие отрицательное значение электродного потенциала, растворяются в кислотах с концентрацией (активностью) ионов водорода 1 моль/л.
Если электродный потенциал металла имеет положительный знак, то металл является окислителем по отношению к водороду и не вытесняет его из растворов, содержащих по 1 моль/л ионов водорода и катионов металла, а, наоборот, водород вытесняет металл из раствора соли.
