
OCT_labs / lab-D
.pdf
98
3.2. Получение 1,3-бутадиена (дивинила) из этанола по методу С.В. Лебедева
3.2.1. Цель работы.
Ознакомить с основными закономерностями сложного многостадийного процесса, в котором используют полифункциональный катализатор; рассчитать и интерпретировать полученные технологические критерии и параметры процесса.
3.2.2. Введение
Дивинил (1,3-бутадиен СН2=СН-СН=СН2) - первый член гомологического ряда углеводородов с сопряженной двойной связью, бесцветный газ со специфическим запахом, конденсирующийся в жидкость при - 4,3ОС (атмосферное давление). С воздухом 1,3-бутадиен образует взрывоопасные смеси в пределах концентраций 2,0 - 11,5 % объемн., его химические свойства определяются наличием сопряженных двойных связей. Дивинил является основным мономером для производства синтетических каучуков. При сополимеризации дивинила со стиролом, метилстиролом и акрилонитрилом образуется макромолекула, в которой 1,3-бутадиен связывается в 1,4 или 1,2 положениях:
CH2 CH
CH2 |
|
CH |
|
CH |
|
CH2 |
|
, |
|
|
|
CH |
|||||||||||
|
|
|
|
||||||||
CH2
Особенно ценные свойства имеет цис-бутадиеновый каучук, получаемый полимеризацией дивинила преимущественно в 1,4- положении с цис-расположением атомов водорода при двойной связи:
[ |
|
|
CH2 |
|
|
CH |
|
CH |
|
CH2 |
|
]n |
|
|
|
|
|
|
|
||||||
В СССР в 40-х |
годах |
получил широкое распространение синтез |
||||||||||
1,3-бутадиена из этанола по способу С.В.Лебедева. В настоящее время ввиду использования сравнительно дорогого сырья, низких показателей
и сложности |
разделения |
продуктов |
в |
этом |
синтезе, |
|
основными методами производства |
1,3-бутадиена |
являются |
||||
99
дегидрирование н-бутана и н-бутена, а также выделение бутадиена из продуктов пиролиза фракции нефти. Поэтому данная лабораторная работа имеет главным образом методическое значение.
3.2.3. Теоретические основы процесса
Химия, равновесие и выбор катализатора. Образование
1,3-бутадиена из этанола описывается общим уравнением
2С2Н5ОН С4Н6 + 2Н2О + Н2 - 80 кДж/моль |
(3.2.1) |
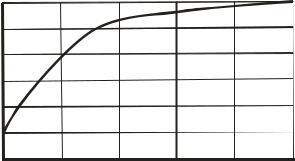
Термодинамические расчеты показывают, что образование 1,3- бутадиена возможно при сравнительно низких температурах. Как видно из графика (рис. 3.2.1), при повышении температуры равновесный выход дивинила растет и при температуре 330ОС приближается к стехиометрическому. Одновременно с основной реакцией термодинамически разрешено протекание параллельных и последовательных побочных реакций. В результате побочных реакций получаются углеводороды (алканы, алкены и арены), а также кислородсодержащие соединения: спирты, альдегиды, эфиры и кетоны. Алкены и арены в свою очередь полимеризуются и конденсируются с образованием продуктов уплотнения - твердых углистых веществ. Уравнение (3.2.1) – суммарное. Механизм процесса должен включать разные по природе элементарные стадии: отщепление водорода - дегидрирование, отщепление воды – дегидратацию, для образования дополнительных связей С-С необходима реакция конденсации (как один из возможных вариантов). В основу выбора активного и селективного катализатора была положена идея о том, что он должен содержать компоненты, способные ускорять перечисленные реакции (стадии). Лучшим катализатором оказалась система, предложенная С.В. Лебедевым, включающая кислотный катализатор дегидратации на основе Al2O3 , катализатор дегидрирования – ZnO и основной оксид – MgO, катализатор конденсации. При этом механизм может быть представлен следующим образом.
Первой стадией превращения этилового спирта в 1,3-бутадиен является его дегидрирование:
|
ZnO |
|
|
|
1. 2СН3 - СН2ОН |
2СН3 - СНО + 2 Н , |
2 Н Н2 , |
(3.2.2) |
|
где Н |
- адсорбированный на |
поверхности |
катализатора |
|
водород |
|
|
|
|
|
100 |
Далее в результате |
альдольной и кротоновой конденсации |
образуется кротоновый альдегид |
|
MgO |
Al2O3 |
2. 2СН3-СНО СН3-СН(ОН)-СН2-СНО СН3-СН=СН-СНО +Н2О (3.2.3)
Кротоновый альдегид восстанавливается адсорбированным на поверхности оксида цинка атомарным водородом в кротиловый спирт (молекулярный водород плохо активируется оксидом цинка):
ZnO |
|
3. СН3-СН=СН-СНО + 2 Н СН3-СН=СН-СН2ОН |
(3.2.4) |
Кротиловый спирт дегидратируется с изомеризацией в 1,3- бутадиен:
Al2O3 |
Al2O3 |
|
4. СН3-СН=СН-СН2ОН СН3-СН=С=СН2 СН2=СН-СН=СН2 |
(3.2.5) |
|
- H2O |
|
|
,%*
100
80
60
40 |
150 |
200 |
250 |
300 |
350 |
100 |
t,oC
Рис.3.2.1. Зависимость равновесного выхода ( *) 1,3-бутадиена от температуры.
В связи с тем, что синтез бутадиена сопровождается образованием большого количества различных побочных продуктов (до шестидесяти), процесс необходимо проводить в присутствии селективного катализатора.
3.2.4. Выбор оптимального технологического режима.
Основными факторами, влияющими на процесс получения бутадиена, являются катализатор, температура и время контактирования.
101
Активность катализатора и селективность процесса
зависит от соотношения количеств оксидов, входящих в состав катализатора. Изменение этого соотношения почти не влияет на качественный состав получаемых продуктов, но зато сильно отражается на их количествах. Увеличение содержания в катализаторе оксида цинка выше определенной величины приводит к образованию избыточных количеств этаналя. При повышенных концентрациях этаналя, кротонового и других альдегидов будут интенсивно протекать последовательные реакции конденсации с образованием олигомерных продуктов. Повышение против нормы содержания оксида алюминия ускоряет образование этилена и диэтилового эфира (этоксиэтана), получающихся дегидратацией этанола:
С2Н5ОН С2Н4 + Н2О |
(3.2.6) |
2С2Н5ОН (С2Н5)2О + Н2О |
(3.2.7) |
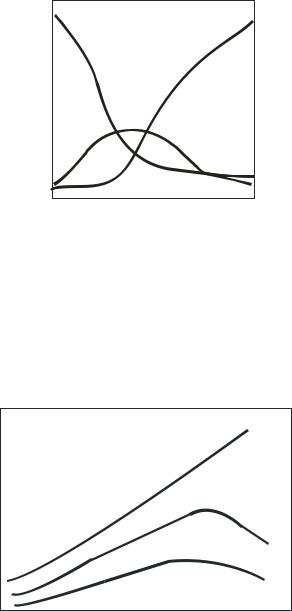
Влияние состава катализатора (мольного соотношения Al2O3 : ZnO) на выходы 1,3-бутадиена и побочных продуктов иллюстрирует рис. 3.2.2. Правильный выбор состава катализатора позволяет проводить все превращения этанола в 1,3-бутадиен с большой скоростью и в одну технологическую стадию.
Несмотря на присутствие катализатора, побочные реакции идут с измеримыми скоростями, и поэтому синтез бутадиена относят к
сложным каталитическим процессам.
При получении 1,3 бутадиена наблюдается довольно быстрое падение активности катализатора. Образующиеся за счет побочных превращений 1,3-бутадиена, других непредельных углеводородов и альдегидов продукты уплотнения отлагаются на активных центрах катализатора, что затрудняет диффузию паров спирта к его поверхности. Процесс регенерации катализатора состоит в пропускании через него воздуха или воздуха с водяным паром при температуре 500550ОС. При этом продукты уплотнения выгорают и катализатор вновь становится активным.
Многократная регенерация при повышенных температурах вызывает постепенное изменение кристаллической структуры катализатора и необратимое падение его активности. В этом случае катализатор заменяют свежим.
102
100
3
2
50
1
0 |
|
0,1 |
10 |
1 |
[Al2O3 ] /[ ZnO]
Рис.3.2.2. Зависимость выходов 1,3-бутадиена и побочных продуктов от соотношения Al2O3 и ZnO в катализаторе, [MgO]=const: 1 - С4Н6, 2 - С2Н4, 3 - СН3СНО
%
x
t,o C
Рис.3.2.3. Зависимость конверсии спирта (Х), селективности процесса( ) и выхода 1,3-бутадиена ( ) от температуры
Температура. Для каталитического процесса выбор температуры определяется, как правило, температурным интервалом, в котором активен применяющийся катализатор. Для катализатора С.В.Лебедева оптимальный температурный диапазон 350-400ОС. Проведенный в этих условиях синтез 1,3-бутадиена представляет собой необратимый процесс (см. рис. 3.2.1). Влияние температуры связано с двумя моментами, имеющими место при любом сложном необратимом

103
химическом процессе. Повышение температуры увеличивает, вопервых, скорость образования целевого продукта – 1,3-бутадиена, вовторых, скорости всех побочных реакций, параллельных и последовательных.
Так 1,3-бутадиен при повышенной температуре олигомеризуется с образованием низкополимерных продуктов, в частности димера бутадиена(4-винилциклогексена):
|
|
CH |
|
|
|
|
CH2 |
|||||||||||
|
|
2 |
|
|
|
|
|
|
|
CH |
CH2 |
|||||||
CH |
CH2 |
|
||||||||||||||||
|
|
+ |
|
|
|
|
|
CH2 |
|
|
|
|
|
|
|
|
|
CH2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
CH |
CH |
|
CH |
|
|
CH |
CH |
|
CH |
|
|||||||
|
|
|
|
|
|
|||||||||||||
|
|
CH2 |
|
|
|
|
CH |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
Зависимость степени превращения спирта, выхода бутадиена и селективности процесса от температуры представлена на рис. 3.2.3. По мере повышения температуры растет конверсия спирта, так как увеличиваются скорости всех возможных реакций в соответствии с их энергиями активации на данном катализаторе. Влияние температуры на выход и селективность образования 1,3-бутадиена характеризуется кривыми с максимумами в сравнительно узком диапазоне температур. Ниже оптимальных температур выход 1,3-бутадиена и селективность процесса малы вследствие относительно небольшой скорости основной реакции, выше - в основном за счет ускорения последовательных реакций дальнейших превращения дивинила.
Время контактирования. Кривые зависимости выхода и селективности образования дивинила и конверсии спирта от времени контактирования имеют тот же характер, что и соответствующие кривые зависимости от температуры. Вначале увеличение времени пребывания исходного вещества в зоне катализатора повышает количество этанола, разлагающегося с образованием бутадиена. При увеличении времени контакта сверх оптимального начинают преобладать вторичные изменения 1,3-бутадиена и превращения этанола в других направлениях. Оптимальное время контактирования тесно связано с температурой. Его выбирают таким образом, чтобы степень превращения этанола была бы невелика, во избежание протекания побочных (главным образом последовательных) реакций. Небольшая степень превращения сырья вызывает необходимость проведения процесса по циркуляционной схеме, причем возможен возврат в процесс не только непрореагировавшего спирта, но и получающегося промежуточного продукта - ацетальдегида (этаналя).
104
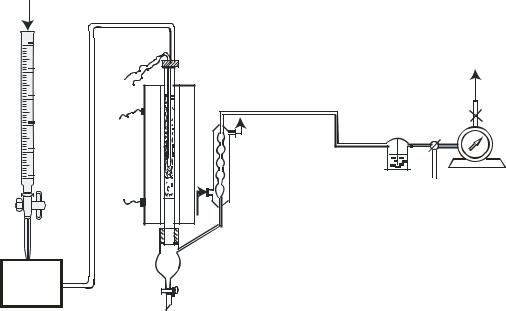
3.2.5.Описание лабораторной установки.
Влабораторных условиях могут быть использованы два варианта установок, отличающихся способом подачи этанола (рис.3.2.4). Этанол подается в реактор 2 , заполненный катализатором, с заданной скоростью с помощью дозатора . В качестве дозатора используются капельная воронка или дозирующий насос 1 с бюреткой 9. Реактор помещен в электрическую печь 3. Температура в реакторе поддерживается постоянной с помощью терморегулятора. Введенный в реактор спирт испаряется на нагретой кварцевой насадке и в виде паров поступает в зону реакции. Продукты реакции и непрореагировавший спирт попадают в нижнюю часть реакционной трубки и частично конденсируются в приемнике 4, с краном А для слива жидких продуктов. Несконденсировавшиеся пары летучих соединений и газообразные продукты проходят через отводную трубку приемника в водяной холодильник 5. После дополнительной конденсации легколетучих
веществ контактный газ проходит через склянку Тищенко 6, заполненную концентрированным раствором гидроксида натрия. В склянке Тищенко осмоляются и задерживаются ацетальдегид и диэтиловый эфир. Затем газообразные продукты поступают в газосчетчик 7, с помощью которого измеряется расход газа, и направляются в коллектор выхлопных газов. Зажим B предназначен для отсоединения неработающей установки от коллектора выхлопных газов. Трехходовой кран 8 предназначен для отбора пробы газа для определения состава методом газоабсорбционной хроматографии.
3.2.6.Порядок проведения опыта.
1.Взвешивают на электронных весах (с точностью до 0,1 г): колбу для конденсата с пробкой, склянку Тищенко со щелочью и делительную воронку с пробкой. При работе на установках с капельной воронкой взвешивают также примерно 40 мл этанола в колбе с пробкой. Спирт заливают в бюретку емкостью 100 мл (в случае использования дозирующего насоса) или в капельную воронку. Присоединяют склянку Тищенко и подают воду в холодильник.
2.Включают обогрев реактора синтеза дивинила. Снимают зажим
Вдля соединения установки с линией сброса газов.
3.После достижения температуры в зоне катализатора (около 400ОС) начинают подачу этанола с заданной скоростью. При подаче спирта с помощью дозатора необходимо проконтролировать, чтобы весь шланг на линии подачи спирта был заполнен спиртом (до высшей точки). Скорость подачи спирта из капельной воронки регулируют краном. Продолжительность опыта задается преподавателем (обычно 30 – 40
105
мин). Через каждые 5 мин записывают в табл. 3.2.1 температуру, скорость подачи спирта (уровень спирта в измерительной бюретке или кап/мин) и показания газосчетчика с точностью до сотых долей литра.
этиловый
спирт
|
|
|
|
|
сброс |
|
9 |
|
|
|
В |
|
|
|
|
H2O |
|
|
|
3 |
|
7 |
|
|
|
|
|
||
|
|
5 |
|
8 |
|
|
|
|
|
||
|
|
|
|
6 |
|
|
|
|
|
|
|
|
2 |
H2O |
|
|
|
|
|
|
|
|
|
|
4 |
|
|
|
|
1 |
|
A |
|
|
|
Рис. 3.2.4. Схема лабораторной установки синтеза дивинила по методу С.В.Лебедева.
4.В процессе эксперимента лаборант отбирает пробу газа через трехходовой кран 8 для хроматографического анализа.
5.По истечении заданного времени после очередного замера прекращают подачу спирта выключением дозатора или перекрыванием крана капельной воронки. При работе на установке с капельной воронкой остаток спирта из капельной воронки сливают в колбу для спирта. Через 5 мин, необходимых для того, чтобы прореагировал
поданный на контактирование спирт, выключают обогрев реактора. После охлаждения реактора до примерно 2000С записывают показания газосчетчика; содержимое приемника 4 сливают в колбу для конденсата
спробкой. После этого отсоединяют склянку Тищенко, обязательно заменив ее соединительной трубкой (во избежание попадания газообразных продуктов реакции в атмосферу). Прекращают подачу воды в холодильник. Взвешивают склянку Тищенко, колбу с содержимым приемника (конденсатом) и колбу с остатком спирта (при работе на установке с капельной воронкой)
6.Жидкие продукты (конденсат) разделены на два слоя. Верхний слой - смесь углеводородов, нижний - спирто-водный конденсат. Их переносят в предварительно взвешенную делительную воронку с
106
пробкой, добавляют для лучшего разделения двух - трехкратный объем воды и взбалтывают. После отстаивания нижний слой - водный раствор спирта сливают (в вытяжном шкафу), а углеводородный слой взвешивают вместе с воронкой.
Исходные и экспериментальные данные
Дата................................................................................................... |
|
Концентрация этанола............................. |
93 % масс.( ρ = 0,81 г/мл) |
Средняя температура в реакторе....................................................... |
ОС |
Продолжительность опыта........................................................ |
мин |
Барометрическое давление.................................................... |
мм рт.ст |
Температура в лаборатории............................................................. |
..ОС |
Объем катализатора........................................................................... |
мл |
Доля свободного объема катализатора.................................................. |
|
а) Объем спирта в бюретке |
до опыта ……………..мл |
|
|
|
после опыта…………..… мл |
Объем спирта, поступившего в реактор……………………….…... мл б) Масса этанола с колбой и пробкой
после опыта………………………………………………. г до опыта………………………………………..…………..г
Масса спирта, поступившего в реактор……………………………….... г
Для установок с дозатором – пункт – «а»), с капельной воронкой – |
|
пункт - «б»). |
|
Масса склянки Тищенко |
|
до опыта.......................................................................................... |
г |
после опыта..................................................................................... |
г |
Масса альдегида и эфира....................................................................... |
г |
Масса конденсата с колбой и пробкой................................................... |
г |
Масса колбы с пробкой.......................................................................... |
г |
Масса конденсата.................................................................................... |
г |
Масса углеводородов с делительной воронкой.................................... |
г |
Масса делительной воронки.................................................................. |
г |
Масса углеводородов.............................................................................. |
г |
Масса спирто-водного конденсата......................................................... |
г |
Контроль процесса
Детальный качественный и количественный анализ контактного газа достаточно сложен и поэтому определяют только основные компоненты, используя метод газоадсорбционной хроматографии.

107
Описание техники анализа и приемы расчета хроматограммы даны в Приложении. Результаты хроматографического анализа заносят в табл.3.2.2.
Таблица 3.2.1.
Экспериментальные результаты опыта.
Время от |
|
Расход спирта |
|
|
начала |
|
|
|
|
опыта, |
|
|
|
|
Показания по бюретке, мл |
||||
мин |
(или скорость подачи спирта, |
|||
|
|
|
кап/мин) |
|
|
|
|
|
|
|
Уровень |
|
Разность |
Расход |
|
спирта в |
|
этого и |
мл/мин |
|
бюретке |
|
преды- |
|
|
|
|
дущего |
|
|
|
|
замера |
|
0 |
|
|
|
|
5 |
|
|
|
|
10 |
|
|
|
|
15 |
|
|
|
|
20 |
|
|
|
|
25 |
|
|
|
|
30 |
|
|
|
|
35 |
|
|
|
|
40 |
|
|
|
|
после |
|
|
|
|
охлаждения |
|
|
|
|
реактора |
|
|
|
|
Количество Показания газа, газосчетполученное
чика в за данное данный время, л момент,
л
Общее количество газа за время опыта (при температуре и давлении в лаборатории)………………………..л
Общее количество газа за время опыта,
пересчитанное к н.у…( VГн.у. )……………………………………………л
