
voltamper
.pdfВВЕДЕНИЕ
Вольтамперометрия - электрохимический метод анализа и иссле дования, основанный на регистрации и использовании зависимости ме
жду силой тока в цепи электролитической ячейки и напряжением (потен циалом). Различают прямую и косвенную вольтамперометрию. Косвен
ную вольтамперометрию называют амперометрическим титрованием или титрованием по току.
Для осуществления вольтамперометрических измерений в ячейку с исследуемым раствором помещают индикаторный микроэлектрод (т.е.
электрод с малой площадью поверхности) и вспомогательный электрод,
потенциал которого остается практически неизменным при электролизе.
На индикаторном микроэлектроде происходит восстановление или
окисление электрохимически активных веществ, часто называемых де
поляризаторами.
В качестве индикаторных электродов используют стационарные и вращающиеся металлические (ртуть, платина, золото) и углеродные
(графит, стеклоуглерод, углеситалл) электроды, а также капающий ртут
ный электрод. Последний используется наиболее широко. Вольтамле рометрия с капающим ртутным электродом называется полярографией
или полярографическим методом анализа.
Особенностыо вольтамперометрии является то, что сила тока в
цепи зависит от процессов, происходящих на микроэлектроде. При этом
за время измерения электролизу подвергается ничтожная доля анали
зируемого вещества. Поэтому для одной и той же порции раствора мож но получить хорошо воспроизводимые результаты измерений.
Электролиз на индикаторном микроэлектроде происходит вследст вие того, что этому электроду сообщается потенциал, величина которого
значительно отличается от равновесного значения. Иными словами, по
тенциал электрода является фактором, благодаря которому определяе
мое вещество реагирует на электроде, поэтому он называется фактором
возБУ)fЩения.
По скорости изменения фактора возБУ)fЩения вольтамперометри
ческие методы анализа разделяются на классические и релаксацион
ные. В классических методах потенциал индикаторного электрода меня
ется во времени медленно (1-30 мВ/с) и наблюдаемые явления близки к
равновесным. Для релаксационных методов характерны высокие скоро
сти изменения фактора возбуждения (1-100 В/с).
К классическим методам относится рассматриваемая в данном по собйи полярография постоянного тока. Методы импульсной и перемен нотоковой полярографии являются примерами релаксационных мето
дов.
4
http://www.mitht.org/forum
1. ПОЛЯРОГРАФИЯ ПОСТОЯННОГО ТОКА
1.1. Основные понятия
Полярография ПОСТОЯ~IНОГО тока основана на получении и исполь
зовании зависимости между силой постоянного тока и l-tапряжеttием, по
даваемым на электроды при электролизе анализируемого соединения.
В качестве ИНДИl<атор'IOГО электрода в полярографии используется ртутный I<апающий электрод. В ходе полярографических определений
потенциал этого электрода меняется линейно с небольшой скоростью. МИl<роэлектрод, потенциал которого меняется в 11роцессе измерения, на
зывается полnризуемым электродом. Ртутный I<апающий (поляризуе мый) электрод формируется в виде небольших rю размеру капелек рту ти, вытекающих из стеклянного капилляра малеllЬКОro диаметра. Ртуть подается в капилляр из напорного резервуара через толстостенный
шланг. Электрод помещают в анализируемый раствор вместе со вспо
могательным элеl<ТРОДОМ, который называют еще противоэлектрод. Со суд с а~lализируемым раствором, в который помещают элеl<ТРОДЫ, Ila- зывается электролизером или полярографической ячейкой (в Aall~IOM
случае, двухэлектродной ячейкой).
В качестве вспомогательных электродов в полярографии часто ис
пользуют насыщенный каломеЛЫIЫЙ электрод с большой поверхностью
(макроэлектрод) или в простейшем случае применяют слой ртути на дне полярографической ячеЙI(И (донную ртуть). В двухэлектродной ячей ке вспомогательный электрод выполняет две фуltl<Ц~1И: является одним из электродов для осуществления элеl<тролиза (вспомогатеЛЫiЫМ элек тродом) и электродом, по отщ,шению к которому измеряется потенциал
ртутного капающего электрода (т.е. является электродом сравнения).
Потенциал вспомогателыюro электрода в ходе электролиза остается
практически постоянным, поэтому электрод называю неполяризуемым.
Лринципиальн~я схема простой ·полярографическоЙ ус:гановки приведена на рис.1.1. Постоянное напряжение (3 - 4 В) от источника пи тания под.Эется на концы 'переменного резистора (реохорда). При пере
мещении ПОДI!IИЖНОГО контакта по реохорду происходит изменение пода
ваемщо на эhектроды напряжения. Прилагаемое к ячейке t-iаПР$lже~lие U
расходуется .напреОдоление разности потенциалов между Эi1~f{тродами
и прохождение тока в растворе и определяется соотношением:
u= Еа - Ej( + I Н,
где - Еа t:10тенциал анода, Ek - потенциал катода, 1 - сила тока, R - сопротивление раствора.
5
http://www.mitht.org/forum
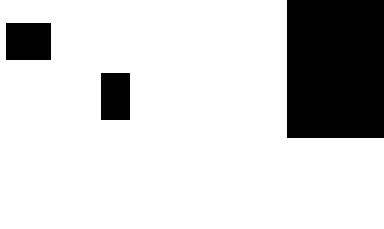
|
|
|
г5 |
----------- |
|
----------1 |
|
< -------- |
|
( 7f |
|
|
:_____ _ |
||
|
-(катод) |
|
|
|
|
|
|
|
|
|
|
2 |
|
1 _ |
|
|
|
|
~---- |
~ |
-.. |
|
|
|
|
|
|
||||
|
|
|
6 |
: |
|
|
|
|
|
|
-------- |
|
|
|
|
|
|
|
|
: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
: |
|
|
|
|
|
|
|
: |
|
|
-Е |
|
|
|
|
|
|
||
|
|
|
|
, |
|
|
|
|
|
|
|
, |
|
|
|
|
|
|
|
, |
|
|
|
|
|
|
|
: |
|
|
|
|
|
|
|
: |
|
---- -- --- _ -- -- - _ ф_ -- _ |
|
|
|
|
|
: . -- -- - _ ........... |
|
||
___.J + (анод)
7
Рис.1.1. Принципиальная схема полярографической установки
1- источник напряжения; 2- реохорд; з- ячейка; 4- ртутный капающий электрод; 5 - гальванометр; 6- вольтметр; 7- аlЮД (донная
ртуть)
в полярографии к анализируемому раствору добавляется сильный
электролит, не принимающий участия в электродной реакции, так назы ваемый индифферентный электролит или фон. Добавление фона обу
словливает сравнительно низкое сопротивление раствора (200-400 Ом).
При силе тока 10·5 - 10·7А, которая имеет место при измерениях, вели
чина IH мала и ею можно пренебречь. Потенциал электрода сравнения, (макроэлектрода) практически остается постоянным при прохождении тока. Поскольку принято потенциал индикаторного электрода измерять по отношению к электроду сравнения (Еа = О), приложенное к ячейке напряжение равно потенциалу ртутного капающего электрода, т.е. U = - Ek , если индикаторный электрод является катодом. Вследствие этого в полярографии и родственных ей методах рассматривается не прило
женное к электродам напряжение, а потенциал микроэлектродэ.
При анализе растворов, обладающих большим сопротивлением,
например в органических растворителях, приведенное соотношение ме жду напряжением и потенциалом микроэлектрода не является справед
ливым. В таком случае используют трехэлектродные ячейки, в которых
функции вспомогательного электрода и электрода сравнения выполня
ют самостоятельные электроды.
6
http://www.mitht.org/forum

1.2. Полярограмма и ее особеt'НОСТИ
Графическая зависимость I - Е называется ГlOлярограммоЙ. Хара,<
терная кривая зависимости силы то,<а от потенциала PТYTlIoro капающе
го электрода получается при наличии в анализируемом растворе соеди
нения, способного восстаllавливаться (рис.1.2.).
|
пределыlйй TOI(~л / |
|||
~ |
|
I |
----....~-'.. |
|
|
=;/ |
~ Boccra'i08- |
.: |
|
|
...-------:::==--f.- ---- |
: |
||
~ |
11 |
/2 |
леllие фона |
|
m |
( |
, |
|
|
~ |
|
/1: |
/ |
|
о |
j' |
' |
, |
|
~ |
1~~~~~~~!~!ЙТО'( |
|
||
_=-/-.----~ |
1 |
|
||
L -_____~'________ ., - Е
Е1/2
РИС.1.2. Полярографичес,<ая кривая - полярограмма: 1 - кривая фона; 2 - полярографичес,<ая волна.
I(ривая состоит их трех характерных учасТl<ОВ. При потенциалах,
недостаточных для протеl(ания электродной реакции, через ячеЙI<У rlpo- текает небольшой по веЛИЧИllе ТОI<, называемый остаточным током. Причины протеr<ания этого тока будут paccMoTpellbI tiиже. Второй уча
сток полярограммы начинается при потенциалах РТУПlого капающего
электрода, достаточных для разряда ОГlределяемого вещества. При этих
значениях потенциапа в электродную реакцию вступают (восстанавли
ваются) прежде всего наиболее богатые эt,ергией частицы аllапизируе мого вещества. Черезэлеl<ТРОДЫ начинает протеlШТЬ ток, обусловлен
ный разрядом частиц на электроде и называемый фарадееВСI<ИМ TOI<OM.
Отметим, что сила фарадееВСI<ОГО TOI<a проrlOрциональна сr(ОРОСПI превращения анализируемого вещества на электроде. Как и для хими
ческих реакций, CI(OPOCTb электродной реакции определяется I(оличест
вом вещества, которое реагирует в единицу времени. В соответствии с
заl<ОllOМ Фарадея, количество реагирующего на электроде вещества
пропорционалыlO количеству элеraричества, которое, в свою очередь,
определяется силой протекающего тока. Поэтому скорость эле'{ТРОДIIОЙ
реакции оказывается пропорциональноi1 силе ТО'(8.
ПО мере дальнейшего увеличения потенциала на электроде реаги
руют и .IЭСТИЦЫ С меньшей энергией. НаПОМIIИМ, что Ч~1СЛО этих частиц растет ЭI(споненциалыю с убылью их энергии в соответствии с распре
делением Максвелла-Больцмана. Поэтому так же растет и сила тока,
пропорциональная скорости электродной реакции (рис.1.2., восходящая
7
http://www.mitht.org/forum
ветвь кривой 2).
Увеличение тока с ростом потенциала происходит до некоторого
предела. После этого достигается область потенциалов, в которой ток
(скорость электродной реакции) имеет максимальное значение и почти
не зависит от потенциала. Этот ток называется предельным. Получаю щаяся кривая 1- Е по форме напоминает ступеньку или волну, поэтому ее называют полярографической волной. Разность между предельным током и током перед волной (остаточным током) называют высотой вол ны. Обычно высота волны зависит от концентрации анализируемого (электрохимически активного) компонента в растворе. Большинство аналитических методик полярографического анализа основано на уве
личении высоты волны с ростом концеlпрации.
В зависимости от стадии, определяющей скорость электродного
процесса, предельный ток может быть диффузионным, кинетическим или каталитическим. Подробнее природа предельного тока будет рас
смотрена ниже.
Кроме высоты волны важным параметром полярографической
кривой является потенциал полуволны (Е1I2), Т.е. потенциал, соответст вующий середине высоты волны. В отличие от высоты волны потенциал
полуволны часто не зависит от концентрации определяемого вещества, а зависит от природы вещества, подвергающегося электролизу на мик
роэлектроде, и в некоторых случаях близок по величине к стандартному окислительно-восстановительному потенциалу этого вещества. Поэтому величину Е1I2 можно использовать для качественного анализа. Если в
растворе присутствует несколько элекrрохимически активных веществ,
то на полярограмме может наблюдаться несколько волн, каждая из кото
рых отвечает определенному компоненту.
Для характеристики полярографической кривой важна таЮl<е фор
ма волны, под которой понимается наклон восходящей ветви волны к оси потенциалов. Этот наклон зависит от числа электро~IOВ, принимаю
щих участие в электродном процессе, а также от скорости переf-lоса
электронов (см. понятие об обратимых инеобратимых процессах).
Во всех современных разновидностях полярографического анали
за получаются кривые, характеризующиеся двумя параметрами, один из
которых пропорционален концентрации (как высота волны), а другой
аналогичен Е1I2 и зависит от природы вещества, подвергающегося элек
тролизу. и состава среды (т.е. природы растворителя и фона).
1.3. Токи в полярографии
Электродные процессы, используемые в полярографии, связаны с
переносом электронов через границу раздела электрод-раствор, Т.е. яв
ляются гетерогенными процессами. В результате этих процессов проис
ходят электрохимические превращения, которые подчиняются закону
Фарадея и называются фарадеевскими. Однако не весь ток получается
8
http://www.mitht.org/forum
за счет разряда электроактивного вещества (деполяризатора). Во всей
области потенциалов регистрации полярографической кривой ~Ia граNИ це раздела раствор-электрод происходят процессы и без электролиза, т.е. без переноса электронов. Наличие таких процессов приводит к воз никновениlO токов, которые называlOТСЯ нефарадеевскими и которые
следует учитывать.
В данном разделе рассмотрена природа остаточного и предельно
го токов.
1.3.1. Остаточный ток
Наличие остаточного тока 'OCJ. (рис. 1.2.) обусловлено двумя причи нами. Первая - это восстаtювление следовых количеств примесей, почти
всегда присутствующих в растворах: следов растворенного кислорода,
ионов тяжелых металлов, содержащихся в растворителе и фоновом
электролите. Обычно концентрация этих примесей настолько мала, что . их восстановление не дает четких волн, но вносит определенный вклад в наблюдаемый остаточный ток. Эта составляющая остаточного тока называется фарадеевской (I F ). Фарадеевская составляющая остаточно го тока обычно невелика и ее можно уменьшить, используя чистые рас творители, реактивы и тщательно удаляя растворенный кислород.
Второй составляющей остаточного тока является так называемый
конденсаторный ток (Ic), который еще называют током заряжения или емкостным током. Этот ток не связан с разрядом частиц на поверхности
электрода и является нефарадеевским. Конденсаторный ток является
основной составляющей остаточного тока. Протекание конденсаторного
тока (тока заряжения) связано с формировани~м на границе ртутная ка пля - раствор двойного электрического слоя без переноса электронов через границу раздела ртуть-раствор. При образовании двойного элек
трического слоя происходит направленное ДВХlжение заряженных частиц
к поверхности раздела электрод-раствор. Со стороны электрода (ртут
ной капли) этими заряженными частицами будут электроны, а со сторо
ны раствора -: соответствующие· ионы. По поведению граница раздела
электрод-раствор аналогична конденсатору. Заряд электрода по отно
шению к раствору может быть положительным или отрицательным. В
первом случае часть электронов в ртути будет направленно двигаться
от поверхности вглубь ртутной капли, а во втором случае - к поверXlЮ сти ртути. При увеличении отрицательного потенциала электрода пр'о
исходит почти линейное возрастание конденсаторной составляющей ос
таточного тока, т.к. он совпадает по направлению с катодным током.
Как было отмечено ранее, для нахождения аналитического пара метра (высоты волны) остаточный ток необходимо учитывать. Влияние
остаточного тока зависит от того, насколько его величина мала по срав
нению с предельным током. Так, для раствора с концентрацией опреде
ляемого вещества 1о-Эм конденсаторный ток составляет не более 4 %
9
http://www.mitht.org/forum
предельного тока. Если же концентрация определяемого вещества рав
на 10·5М, то конденсаторный ток в 4 раза больше тока, соответствующе
го высоте волны. Очевидно, что если в первом случае величиной оста точного тока можно пренебречь, то во втором случае точно определить
полезную составляющую трудно.
1.3.2. Предельный ток
Электродные процессы в полярографии (вольтамперометрии) яв ляются многостадийными. В простейшем случае можно выделить 3 ста
дии электродного процесса: 1) подача деполяризатора к электроду; 2)
перенос электронов, т.е. собственно электрохимическая стадия разряда;
3) отвод продуктов электродной реакции от поверхности электрода. Электродные процессы (реакции) могут осложняться химическими
стадиями, протекающими как до, так и после электрохимической стадии.
Кроме того, электродные процессы, являющиеся гетерогенными, в ряде
случаев сопровождаются адсорбционными явлениями на поверхности
электрода.
Как и для любой многостадийной химической реакции, скорость
электродной реакции определяется наиБОf.lее медленной стадией, ли митирующей общую скорость процесса. В полярографии наличие опре
деленной лимитирующей стадии электродного процесса отражается на высоте и форме волны и ее положении на оси потенциалов.
Сначала остановимся на стадиях, определяющих природу пре дельного тока. Напомним, что он достигается,· когда подводимая к элек
троду энергия, реализуемая в виде потенциала электрода, достаточна
для разряда практически всех частиц, находящихся у электрода. При
этом ток (скорость электродной реакции) имеет максимальное значение и почти не зависит от потенциала (рис.1.2). Следовательно, в области потенциалов, соответствующих предельному току, стадия разряда (т.е. переноса электронов) не является лимитирующей.
В зависимости от стадии, определяющей скорость электродного
процесса, предельный ток может быть диффузионным, кинетическим или каталитическим. Знание природы предельного тока в значительной
степени определяет аналитические возможности поляррграфического
определения.
1.3.2.1. Диффузионный ток
Доставка электроактивного вещества из глубины раствора к по
верхности электрода (массоперенос) может осуществляться в общем
случае тремя путями:
1)диффузией, пропорциональной градиенту концентрации;
2)миграцией (за счет движения заряженных частиц под действием электрического поля);
10
http://www.mitht.org/forum
5) конвекцией (за счет перемешивания).
В полярографических методах стремятся к тому, чтобы массопе ренос осуществлялся исключительно диффузией. В этом случае наблю даемые закономерности наиболее просты и MOryт быть легко рассчита ны. Поэтому для предотвращения принудительной конвекции растворы в процессе получения полярограмм не перемешивают. В некоторых слу
чаях конвективная составляющая массопереноса все же появляется, что
приводит к осложнениям при обработке полярографических кривых (см. «Полярографические максимумы").
В отсутствие конвекции заряженные частицы (например, катионы)
должны лереноситься к поверхности электрода за счет диффузии и миг рации. Тогда максимальная скорость электродного процесса, выражен ная через величину предельного тока (Jn) является суммой, двух состав ляющих: диффузионного тока, контролируемого диффузией, (Id) и ми грационного тока, контролируемого миграцией (IM). Следовательно,
'п = Id + 1м.
Для устранения миграционного тока к анализируемому раствору добавляется так называемый индифферентный электролит (фон). В ка честве индифферентного электролита используют хорошо диссоции
рующие вещества, ионы которых разряжаются при высоких отрица
тельных потенциалах.
Концентрация индифферентного электролита должна превышать
концентрацию определяемого компонента не менее чем в 50-100 раз. В присутствии индифферентного электролита под действием электриче
ского поля будут перемещаться пр~ктически только ионы фона. В таком случае миграция частиц определяемого вещества будет устранена. Введение фонового ~лектролита, кроме того, способствует уменьшеliИIO
сопротивления раствора, что позволяет в ряде случаев работать с двух
электродной полярографической ячейкой.
Предельный ток при добавлении индифферентного электролита
может изменяться или не изменяться в зависимости от знака заряда
частиц деполяризатора. Рекомендуем самостоятельно решить, как по
влияет добавление фона на предельный ток при восстаНQвлении катио
нов, анионов и незаряженных частиц (например, молекул органических
веществ, Н2О2 и др.).
Таким образом, при исключении механического перемешивания и
элект-ростатического притяжения перенос разряжающихся частиц депо
ляризатора к поверхности электрода осуществляется только за счет
диффузии. Скорость диффузии (VдиФ.) пропорциональна разности кон
центраций в двух слоях раствора:
Vдиф. = К(СО - Cs),
где К- коэффициент пропорциональности; Со и Cs - концентрации
деполяризатора в общей массе (объеме) раствора и у поверхности
11
http://www.mitht.org/forum
электрода соответственно.
Заметим, что Cs уменьшается по мере увеличения потенциала электрода, а следовательно, сила тока, лимитируемая диффузионным массопереносом, увеличивается (подъем тока на полярографической
волне, рис.1.2.). Если наложенный потенциал достаточно отрицателен,
концентрация деполяризатора в приэлектродном слое Cs становится
близкой к нулю, по сравнению с концентрацией в массе раствора. В та ком случае скорость диффузии и, следовательно, сила тока становятся
постоянными.
Количественная зависимость диффузионного тока от различных
факторов достаточно хорошо описывается уравнением (1.1.), которое называется уравнением Ильковича. ДЛЯ 250 С
1 |
2 |
1 |
|
Id=605'П.D2.mЗ.tS .со |
(1.1.) |
||
где Id- средний диффузионный ток; n - число электронов, прини
мающих участие в электродном процессе; D - коэффициент диффузии
определяемого вещества; m - масса ртути, вытекающей из капилляра в единицу времени; t - период капания; Со - концентрация деполяризатора. Числовой коэффициент 605 представляет собой произведение несколь
ких констант.
Часто средний диффузионный ток, описываемый уравнением (1.1.), называют просто диффузионным током и обозначают символом Id• Если полярографический анализ проводится с одним И тем же вещест
вом, то n и D являются постоянными. При работе с одним и тем же ка
пилляром и сохранении постоянной высоты столба ртути остаются по стоянными m и t. Тогда, уравнение (1.1.) принимает вид:
Id =К'Со, |
(1.2.) |
где К - константа, Со- концентрация деполяризатора.
Это наиболее важное следствие из уравнения Ильковича, лежа щее в основе количественных полярографических определений.
Линейный характер зависимости предельного тока (высоты волны)
от концентрации определяемого вещества в интервале 10·5-10·2моль/л
является одним из признаков того, что предельный ток является диффу зионным. Для доказательства диффузионной природы предельного тока используют также его зависимость от высоты столба ртути (HHg). Высота
ртутного столба НН9 - это расстояние между верхним уровнем в резер вуаре и кончиком капилляра, из которого формируется ртутный капаю
щий электрод. Поскольку величина m прямо, а t обратно пропорцио нальны высоте ртутного столба, то подстановка в уравнение Ильковича
дает
12
http://www.mitht.org/forum
2 1 |
2 [ |
]~ |
1 |
(1.3.) |
|
'd-m3.t6-(HH |
)3. |
_1_ |
|
-H~ . |
|
9 |
|
HHg |
|
9 |
|
Следовательно, предельный ток, ограничеНttый диффузией, про порционален корню l<вадрапiOМУ из высоты столба ртути.
Характерным является таJOке влияние температуры на величину
диффузионного тока. Температура влияет на ряд перемеНltых, входя щих в уравнение ИЛЬКОВ~1ча. Наиболее чувствительным к изменению температуры является коэффициент диффузии. По этой причине изме нение температуры влияет Ila величину предельного тока. Обычно из менение диффузионного тока составляет 1,5 - 2,5 % на градус. Поэтому для точных полярографических измерений необходимо контролировать
температуру.
1.3.2.2. Кинетический ток
Электродные процессы с предельным диффузионным током ~taxo дят ОС~lOвное аналитическое примеliение в ПОJ1ярографии постоянного тока. Однако HepeAI<o величина предельного тока определяется скоро стыо химической реакция образования электрохимически актив~IOГО ве щества в слое раствора у электрода. Такие электродные процессы не
удобны ДЛЯ аналитического применения.
Если обозначить символом Е стадию переноса электрона, а симво лом С - химическую стадию, то схему электродного процесса с пред шествующей химической стадией (СЕ - процесс) можно представить в
следующем виде:
К
у _1_) А (стадия С),
~-К::-
2
А + пе ~ В (стадия Е),
где 1<1 И К2 - константы скорости химической реакции первого по
ОЯ/lка. В соответствии с приведенной схемой это означает, что ollpeAe-
ляемое вещество ~, I<оторое в определенном диапазоне потенциалов электрохимически I-tеактивно, вступает в химическую реащиlO с обfJi.JЗО еаtlием вещества А, способного восстанавливаться. Количество разря
жаlOщегося на электроде вещества А и, следовательно, величина TOI{a должны зависеть от константы равновесия химической реаl'ЦИИ. ЕСJ1И ,'nнстанта равновесия химической реакции мала (т.е. КI «К2), то 1l0СТУ
пг,ение разряжающегося вещества к электроду полностью определяется
скоростыо химической реакции. В этом случае предельный ток называ
ется кинетичеСI(ИМ ('киtt.).
Примером процесса, ограниченного скоростыо предшествующей
13
http://www.mitht.org/forum
