
s-elements
.pdf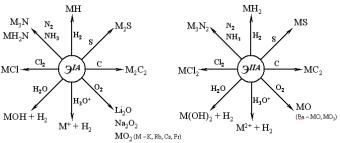
S – ЭЛЕМЕНТЫ
1.Общая электронная формула:
ns1
ns2 ns1np1
2.Важнейшие характеристики:
Элемент |
Tпл. |
|
С |
Tкип. |
|
С |
|
, г/см |
3 |
|
Радиус, |
|
E1 |
|
|
, В |
|
|
|
|
|
|
|
иониз. |
Hгидр. |
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
атома |
|
катиона |
|
|
|
|
3Li |
180 |
|
1340 |
|
0.53 |
|
0.97 |
1.57 |
|
0.76 |
520 |
-587 |
-3.05 |
||||
11Na |
98 |
|
|
886 |
|
|
0.97 |
|
1.01 |
1.92 |
|
1.02 |
496 |
-473 |
-2.71 |
||
19K |
63 |
|
|
776 |
|
|
0.86 |
|
0.91 |
2.36 |
|
1.38 |
419 |
-389 |
-2.93 |
||
37Rb |
39 |
|
|
696 |
|
|
1.52 |
|
0.89 |
2.53 |
|
1.52 |
403 |
-364 |
-2.93 |
||
55Cs |
29 |
|
|
705 |
|
|
1.87 |
|
0.86 |
2.74 |
|
1.67 |
376 |
-340 |
-2.92 |
||
87Fr |
23 |
|
|
669 |
|
|
2.40 |
|
0.86 |
- |
|
1.80 |
380 |
- |
- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
E2иониз. |
|
|
|
4Be |
1283 |
2470 |
|
1.86 |
|
1.47 |
1.12 |
|
0.27 |
1756 |
-2619 |
-1.76 |
|||||
12Mg |
650 |
|
1103 |
|
1.74 |
|
1.23 |
1.60 |
|
0.57 |
1450 |
-2058 |
-2.37 |
||||
20Ca |
850 |
|
1490 |
|
1.54 |
|
1.04 |
1.97 |
|
1.00 |
1145 |
-1712 |
-2.87 |
||||
38Sr |
770 |
|
1357 |
|
2.60 |
|
0.99 |
2.15 |
|
1.18 |
1064 |
-1579 |
-2.89 |
||||
56Ba |
710 |
|
1634 |
|
3.50 |
|
0.97 |
2.22 |
|
1.35 |
965 |
-1441 |
-2.90 |
||||
83Ra |
960 |
|
1536 |
|
5.00 |
|
0.97 |
2.35 |
|
1.48 |
980 |
- |
-2.92 |
||||
В окислительно-восстановительных реакциях – металлы выполняют роль восстановителей:
|
|
|
|
|
|
ЭIA – 1e = ЭIA+ |
|
|
|
|
|
|
|
|
|
|
|
|
ЭIIA – 2e = ЭIIA2+ |
|
|
|
|
|
|
|
Положение в электрохимическом ряду напряжений: |
|
|
|
|
|
|
|||||
|
Li |
Rb |
K |
Cs |
Ra |
Ba |
Sr |
Ca |
Na |
Mg |
Be (Al, Zn, Fe) |
H |
|
-3,05 |
-2,93 |
-2,93 |
-2,92 |
-2,92 |
-2,90 |
-2,89 |
-2,87 |
-2,71 |
-2,37 |
-1,85 |
0,00 |
Бериллий по физико-химическим свойствам резко отличается от остальных элементов IIA – группы. У него
необычно высокое значение E1иониз. = 900 кДж/моль, имеется сродство к электрону АЭ = 10,38 эВ, и поэтому бериллий образует преимущественно ковалентные химические связи с атомами неметаллов.
3. Важнейшие минералы:
IA ГРУППА |
|
ВЗАИМОДЕЙСТВИЕ С ВЕЩЕСТВАМИ |
Галит (каменная соль, поваренная |
NaCl |
|
соль) |
|
|
Сильвин |
KCl |
|
Карналлит |
KCl MgCl2 6H2O |
|
Мирабилит (глауберова соль) |
Na2SO4 10H2O |
|
IIA ГРУППА |
|
|
Магнезит |
MgCO3 |
|
Флюорит (плавиковый шпат) |
CaF2 |
|
Кальцит (мрамор, мел) |
CaCO3 |
|
Доломит |
CaMg(CO3)2 |
|
Гипс |
CaSO4 2H2O |
|
Барит |
BaSO4 |
|
Целестин |
SrSO4 |
|
4.Получение простых веществ:
1)Электролиз расплавов, например LiCl (tпл. = 610 С) катод - (сталь) Li+ + 1e = Li
анод + (графит) 2Cl- + 2e = Cl2
2) Вакумометрическое восстановление (для Be, K, Rb, Cs):
BeF2 + Mg = Be + MgF2 (1000 C)
3) В лаборатории – термическое разложение азидов:
2RbN3 = 2Rb + 3N2
Студенческий портал МИТХТ http://www.mitht.org

Особенности химии магния: |
|
|
|
||
|
4Mg + 10HNO3(разб.) = 4Mg(NO3)2 |
+ NH4NO3 + 3H2O |
|||
|
Mg + 2NH4Cl(конц. гор.) = MgCl2 + 2NH3 + H2 |
||||
Особенность химии Be – амфотерность: |
|
||||
|
Be + 2H3O+ + 2H2O = [Be(H2O)4]2+ + H2 |
|
|||
5. |
Be + 2OH- + 2H2O = [Be(OH)4]2- + H2 |
|
|||
Оксиды и гидроксиды: |
|
|
|
||
|
Оксиды: M2IAO, MIIAO – основные свойства. |
||||
|
Гидроксиды: MIAOH, MIIA(OH)2 (Sr – Ra) – щелочи (диссоциируют полностью), Be(OH)2 – амфотерный, Mg(OH)2, ПР |
||||
|
= 6,8 10-12. |
|
|
|
|
6. |
Пероксиды и надпероксиды: |
|
|
|
|
|
Пероксиды: M2IAO2, MIIAO2 (Ca – Ba) |
сильные окислители в |
|||
|
Надпероксиды: MIAO2 (K – Fr), Ba(O2)2 |
растворе и при сплавлении |
|||
|
Na2O2 + MnO2 Na2MnO4 |
|
|||
|
2Na2O2 |
+ O2 + 2Bi2O3 4NaBiO3 |
|
||
|
3Na2O2 |
+ 2Na3[Cr(OH)6](гор.) = 2Na2CrO4 + 8NaOH + 2H2O |
|||
|
Na2O2 + CO = Na2CO3 |
очистка воздуха |
|||
|
2Na2O2 + 2CO2 = 2Na2CO3 |
+ O2 |
регенерация кислорода |
||
|
2KO2(оранж.) + CO = K2CO3 |
+ O2 |
|||
2+ 2CO2 = 2K2CO3 + 3O2
7.Нитриды: M3IAN, M3IIAN2 – необратимый гидролиз:4KO
Mg3N2 + 6H2O(гор.) = 3Mg(OH)2 + 2NH3
8. Гидриды: MIAH, MIIAH2 – реагируют с водой:
2+ 2H2O(хол.) = Ca(OH)2 + C2H2
9.Карбиды – ацетилениды M2IAC2, MIIAC2 (кроме Be) – необратимый гидролизCaH
CaC2 + 2H2O(хол.) = Ca(OH)2 + C2H2
10. Качественная растворимость солей:
|
F- |
Cl- |
Br- |
I- |
S2- |
SO32- |
SO42- |
NO3- |
PO43- |
CO32- |
Li+ |
н |
р |
р |
р |
р* |
р* |
р |
р |
м |
р/м (t ) |
Na+ |
р |
р |
р |
р |
р* |
р* |
р |
р |
р* |
р* |
K+ |
р |
р |
р |
р |
р* |
р* |
р |
р |
р* |
р* |
Mg2+ |
м |
*р |
*р |
*р |
н |
м |
*р |
*р |
н |
м |
Ca2+ |
н |
р |
р |
р |
*р |
н |
м |
р |
н |
н |
Sr2+ |
н |
р |
р |
р |
*р |
н |
н |
р |
н |
н |
Ba2+ |
н |
р |
р |
р |
*р |
н |
н |
р |
н |
н |
*р - гидролиз по катиону р* - гидролиз по аниону
11.Получение соды NaHCO3 и Na2CO3 (способ Сольве):
1)NH3 + H2O + CO2 + NaCl(насыщ.) = NaHCO3 + NH4Cl
2)2NaHCO3 = Na2CO3 + H2O + CO2 (250 - 300 C)
12.Получение поташа K2CO3 (формиатный способ):
1)K2SO4 + Ca(OH)2 + 2CO = 2HCOOK + CaSO4 (230 C, 15 атм)
2)2HCOOK + O2 = K2CO3 + CO2 + H2O
Студенческий портал МИТХТ http://www.mitht.org
