
аналитика
.pdf11
продукт её (его) нейтрализации. В таком растворе [H3O+]
равна(кислоты) меньше, чем присутствующей кислоты (основания) в
исходном растворе (n(fэкв(X)Х) n(fэкв(T)T); 1 1), то в полученном растворе присутствует непрореагировавшая кислота (основание) и
продукт её (его) нейтрализации. В таком растворе [H3O+] равна концентрации оставшейся кислоты и может быть рассчитана по (57)
или (60). [H3O ] [HX]ост Cо(HX) (1 1) R
Таблица 1
Состав нейтрализуемого раствора в различные моменты протекания кислотно-основной реакции
Нейтрализуемое |
|
Состав раствора |
|
вещество |
До т.э. |
В т.э. |
После т.э. |
|
Х + Т = S |
|
|
X |
X, S |
S |
S, T |
HCl (T-NaOH) |
HCl,NaCl,H2O |
NaCl, H2O |
H2O, NaOH, NaCl |
H3O+ |
H3O+, H2O |
H2O |
H2O, OH- |
NaOH (Т-HCl) |
NaOH,NaCl,H2O |
NaCl,H2O |
H2O, HCl, NaCl |
OH- |
OH-, H2O |
H2O |
H2O, H3O+ |
|
X + T = P + S |
|
|
X |
X,P,S |
P,S |
P,S,T |
CH3COOH |
CH3COOH, |
CH3COONa, |
CH3COONa, H2O, |
(T-NaOH) |
CH3COONa,H2O |
H2O |
NaOH |
H3O+ |
CH3COOH, |
CH3COO-, H2O |
CH3COO-, H2O, |
|
CH3COO-, H2O |
|
OH- |
NH3 H2O (T-HCl) |
NH3 H2O, |
NH4Cl, H2O |
NH4Cl, H2O, |
NH4Cl, H2O |
|
NaOH |
|
OH- |
NH3 H2O,NH4 , |
NH4 , H2O |
NH4 ,H2O,OH |
|
H2O |
|
|
В растворе, содержащем основание, [OH-] и [H3O+] рассчитывают
по: [OH ] [MOH]ост Cо(MOH) (1 1) R
[H O |
] |
KH2O |
|
|
KH2O |
|
|
|
KH2O |
||
|
|
|
|
|
|||||||
3 |
[OH |
|
] |
|
[MOH] |
C |
о |
(MOH) (1 ) R |
|||
|
|
|
ост |
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
1 |
www.mitht.ru/e-library

12
В случае добавления эквивалентного количества компонента
(n(fэкв(X)Х) = n(fэкв(T)T); 1 = 1) концентрация [H3O+] и [OH-]
определяется автопротолизом молекул воды.
[H O |
] [OH ] |
|
|
|
10 14 10 7 |
pH = 7 |
K |
H2O |
|||||
3 |
|
|
|
|
|
После достижения точки эквивалентности, т.е. добавления сверхэквивалентного количества основания (n(fэкв(X)Х) n(fэкв(T)T);
2 1), концентрация [OH-] и [H3O+] определяется избыточным количеством последнего. Их концентрации рассчитывают по (73-75).
[OH ] |
n(MOH)изб |
|
|
C(MOH) V(MOH) Cо(HX) Vo(HX) |
(73) |
||||||||||||
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
Vобщ |
|
|
|
|
Vo(HX) V(MOH) |
||||||||
|
|
|
|
|
[OH-] = Со(HX) ( 2 – 1) R (73-1). |
||||||||||||
|
|
|
|
KH2O |
|
|
|
|
KH2O |
KH2O |
|
|
|
|
|||
[H3O |
|
|
] |
|
|
|
|
|
|
|
|
|
(74); |
||||
|
|
|
|
|
|
Cо(HX) ( |
|
||||||||||
|
|
|
|
[OH ] |
[MOH]ост |
1) R |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
[H O ] |
n(HX)изб |
|
|
C(HX) V(HX) Cо(MOH) Vo(MOH) |
(74.1) |
||||||||||||
|
|
||||||||||||||||
3 |
|
|
|
Vобщ |
|
|
|
|
V(HX) Vo(MOH) |
||||||||
|
|
|
|
|
|
|
|
||||||||||
[H3O+] = Со(MOH) ( 2 – 1) R (75).
Пример. Рассчитать рН раствора после добавления к 20 мл 0,1200 М раствора HClO4 соответственно 10 и 25 мл 0,1080 М раствора NaOH.
Устанавливают состояние системы относительно т.э. Осуществляют это одним из следующих способов. По одному из них рассчитывают количество моль-эквивалентов взаимодействующих веществ и сравнивают их друг с другом. По другому способу, рассчитывают объём раствора NaOH, необходимый для достижения т.э. и сравнивают его с добавляемыми объёмами.
1-ый способ. Рассчитывают n(HClO4) и n(NaOH).
n(HClO4) C(HClO4) V(HClO4) 0,1200 20,00 0,0024M 1000 1000
n(NaOH) C(NaOH) V(NaOH) 1000
www.mitht.ru/e-library

13
а) n (NaOH) |
0,1080 10,00 |
0,001080M |
n(HClO |
) n (NaOH) . |
|
||||
1 |
1000 |
|
4 |
1 |
|
|
|
|
HClO4 не полностью вступила в реакцию, ее избыток определяет [H3O+] и рН получающегося раствора, который рассчитывают по (57) или (60).
|
|
[H3O ] |
0,1200 20,00 |
0,1080 10,00 |
0,044M |
|||
|
20 |
|
|
|||||
|
|
|
|
10 |
20 |
|
|
|
|
|
[H3O ] 0,1200 (1 0,45) |
0,044M |
|||||
|
|
|||||||
|
|
|
|
|
|
20 10 |
||
|
|
0,1080 25,00 |
|
рН = 1,35. |
||||
б)n2 |
(NaOH) |
|
0,0027M |
|
n(HClO4) n2(NaOH). |
|||
|
|
|||||||
|
1000 |
|
|
|
|
|
|
|
NaOH не полностью вступил в реакцию, он в избытке и определяет [OH-], [H3O+] и рН получающегося раствора.
Во втором случае используем уравнение (73) и (73.1).
[OH ] 0,1080 25,00 0,1200 20,00 0,0067M 25,00 20,00
1= 1,12. [OH-]= Со(MOH) ( 2 – 1) R = 0,1080 (1,13-1) 0,44 = 0,0067М
рОН = 1,17 |
pH = 11,83 |
2-ой способ. Рассчитывают объём |
раствора NaOH, необходимый для |
достижения т.э.
V(NaOH)т.э. |
|
C(HClO4 ) V(HClO4 ) |
|
0,1200 20,00 |
22,22мл |
C(NaOH) |
|
||||
|
|
0,1080 |
|
||
V1(NaOH) < V(NaOH)т.э.< V2(NaOH) |
10,00 < 22,22 < 25,00 |
||||
Следовательно, расчет [H3O+] и рН следует проводить так же, как это было сделано ранее.
1.2.2. Растворов слабых кислот и оснований
Если количество добавленного сильного основания (кислоты)
меньше, чем присутствует кислоты (основания) в исходном раст-
воре (n(fэкв(HAn)HAn) n(fэкв(KtOH)KtOH); 1 1), то в полученном растворе присутствует смесь непрореагировавшей слабой кислоты
(основания) и её(его) сопряженного основания (кислоты) - продукта нейтрализации, т.е. соли. По существу, в растворе образуется буферная смесь НAn/МAn (KtOH/KtX). В таком растворе [H3O+] и [OH-] рассчитывается как для буферной смеси. Расчетные уравнения (72) и (72-1) для смеси НAn/МAn можно получить из
www.mitht.ru/e-library

14
уравнения (47), подставляя (59) и (63); а (73) и (73-1) - для смеси
KtOH/KtX из уравнения (49), подставляя также (59) и (63).
[H O |
] K |
|
[HAn] |
|
K |
|
|
Cо(HAn) Vо(HAn) Cо(MOH) V(MOH) |
(72) |
||||||||||
|
|
|
|
||||||||||||||||
3 |
|
a [MAn] |
|
|
|
|
a |
|
Cо(MOH) V(MOH) |
||||||||||
|
|
|
|
|
|
|
|
|
|
Cо(HAn) (1 ) R |
|
|
|
(1 ) |
|||||
|
[H O |
|
] K |
|
|
|
|
|
1 |
K |
|
|
1 |
(72-1) |
|
||||
|
|
|
|
|
|
Cо(HAn) R |
|
1 |
|
||||||||||
|
3 |
|
|
|
|
a |
|
|
|
|
|
a |
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
при неполной нейтрализации слабой кислоты НAn сильным основанием МОН.
[OH ] Kb |
[KtOH] |
Kb |
Cо(KtOH) Vо(KtOH) Cо(HX) V(HX) |
(73) |
||||||
|
|
|
||||||||
|
[KtX] |
|
|
Cо(HX) V(HX) |
|
|
||||
|
|
Cо(HAn) (1 ) R |
|
(1 ) |
|
|
||||
[H3O ] Kb |
|
|
1 |
Kb |
1 |
|
(73 1). |
|||
Cо(HAn) |
R |
1 |
||||||||
|
|
|
1 |
|
|
|
|
|
|
|
при неполной нейтрализации слабого основания KtOH сильной кислотой НХ.
Вслучае добавления к слабой кислоте (основанию)
эквивалентного количества сильного основания (кислоты)
(n(fэкв(HX)HХ) = n(fэкв(MOH)MOH); = 1) в растворе образуется эквивалентное количество соли MAn (KtX), представляющей собой слабое сопряженное основание An- (кислоту, Kt+). В таком растворе
[OH-] и [H3O+] рассчитывают по уравнениям (74) и (75).
MAn + H2O = MOH + HAn |
|
|
|
|
An- + H2O = OH- + Han |
||||||
|
cреда щелочная, т.к. Ka(HAn)<<Kb(MOH) |
||||||||||
[OH ] |
|
|
|
|
|
|
|
|
|
||
Kb(An ) [An ] |
Kb(An ) Cо(HAn) Rт.э. |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
KH2O |
|
C |
о |
(HAn) Rт.э. (74). |
|||||
|
Ka(HAn) |
|
|||||||||
|
|
|
|
|
|
|
|
|
|
||
KtX + H2O = KtOH + HX |
|
|
|
|
Kt+ + H2O = KtOH + H+ |
||||||
среда кислая, т.к. Ka(HAn) Kb(MOH).
www.mitht.ru/e-library
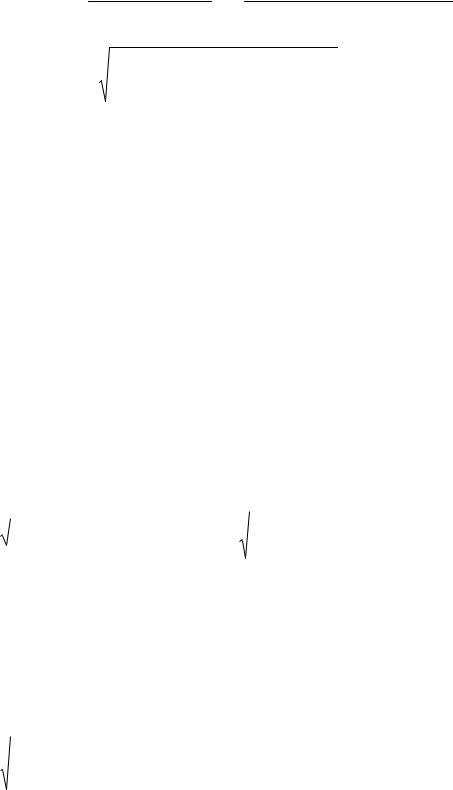
15
[H3O ] 
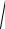 Ka(Kt ) [Kt ]
Ka(Kt ) [Kt ] 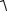
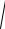 Ka(Kt ) Cо(KtOH) Rт.э.
Ka(Kt ) Cо(KtOH) Rт.э.
|
KH2O |
C |
о |
(KtOH) Rт.э. |
(75) |
Kb(KtOH) |
|
||||
|
|
|
|
|
При добавлении сверхэквивалентного количества сильного(ой)
основания (кислоты) (n(fэкв(X)Х) n(fэкв(T)T); 2 1), концентрация
[OH-] и [H3O+] определяется избыточным количеством последнего,
поскольку существующие также в растворе анионные основания Аn-
(катионные кислоты Kt+) являются слабыми. Рассчитываются соответственно по уравнениям (66,67) и (68).
Пример. Рассчитать объём 0,5500 М раствора NaOH, который следует добавить к 100 мл 0,1100 М раствора СН3СООН для получения раствора с рН, равным соответственно 4,5 и 9,8.
Устанавливают состояние системы относительно т.э. Рассчитывают рН раствора при полной нейтрализации уксусной кислоты, т.е. в т.э.. В таком растворе присутствует только СН3СООNa, представляющий собой слабое
анионное основание СН СОО-. |
|
|
|
||||||||
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
[OH ] |
|
|
|
|
|
|
KH2O |
Cо(CH COOH) R |
|
||
K |
b |
(CH COO ) [CH COONa] |
т.э. |
||||||||
|
|||||||||||
т.э |
|
|
3 |
3 |
|
|
Ka(CH3COOH) |
3 |
|||
|
|
|
|
|
|
|
|
|
|
||
Для достижения т. э. следует добавить следующий объём раствора NaOH:
|
V(NaOH)т.э |
|
Cо (CH3COOH) V(CH3COOH) |
|
0,1100 100 |
20мл . |
|
|||||||
|
|
|
|
0,5500 |
|
|
||||||||
|
|
|
|
|
C(NaOH) |
|
|
|
|
|||||
В этом случае разбавление раствора составит Rт.э. |
|
|
|
100 |
|
0,83. |
|
|||||||
100 20 |
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|||||
[OH ] |
|
1 10 14 |
|
0,1100 0,83 7,16 10 6M; pOH |
|
|
. = 5,14. pH |
= 8,86. |
||||||
|
|
|
|
|||||||||||
т.э |
|
1,78 10 5 |
т.э |
|
|
т.э. |
|
|||||||
|
|
|
|
|
|
|
|
|
||||||
В первом растворе СН3СООН оттитрована неполностью, рН1< pHт.э. В таком растворе, наряду с оставшейся кислотой, присутствует её сопряженное основание СН3СОО- в виде соли СН3СООNa. [H3O+] в такой буферной смеси СН3СООН/СН3СООNa рассчитывается по (69).
www.mitht.ru/e-library
|
|
|
|
|
|
|
16 |
|
|
|
|
|
|
|
|
|
|
|
V(NaOH)1 |
|
C(CH3COOH) V(CH3COOH) |
|
0,1100 100 |
|
|
3,91 мл. |
|||||||||||
|
|
|
|
|
|
5 |
|
|
||||||||||
|
|
|
|
[H30 |
|
] |
|
|
|
|
3,16 |
10 |
|
|
||||
|
|
C(NaOH) |
|
|
1 |
|
0,5500 |
|
|
1 |
|
|||||||
|
|
|
Ka |
|
|
|
|
1,74 |
10 5 |
|
||||||||
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
Во втором растворе СН3СООН оттитрована полностью, рН2 > pHт.э. В нем, кроме образовавшегося слабого анионного основания СН3СОО-, присутствует некоторое количество свободного NaOH. Его присутствие и определяет рН раствора.
|
|
|
n(NaOH) |
С(NaOH) V(NaOH) C (CH3COOH) V(CH3COOH) |
|||||
[OH |
|
] [NaOH] |
|
|
|
|
|
|
|
|
|
|
V(NaOH) V(CH3COOH) |
|
|
||||
|
|
|
Vобщ |
|
|
|
|||
|
|
|
|
|
|
V(CH COOH) (C |
(CH COOH) [OH |
]) |
|
|
|
V(NaOH)2 |
|
3 |
3 |
|
. |
||
|
|
C(NaOH) [OH ] |
|
||||||
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
10 14 |
||
Подставляя в приведённое уравнение [OH |
|
|
] |
|
, получают объём |
|||||
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
10 pH |
|
раствора, необходимый для достижения рН равного 9,8. |
||||||||||
100 (0,1100 |
10 14 |
|
) |
|
|
|
||||
1,58 10 10 |
|
20,01мл. |
||||||||
V(NaOH)2 |
|
|
|
|
|
|
|
|||
|
10 14 |
|
|
|
|
|
||||
|
0,5500 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1,58 10 10 |
|
|
|
|
|
||||
1.2.3. Растворов смесей или полифункциональных кислот
(оснований)
При добавлении к раствору, содержащему смесь кислот
(оснований) или полифункциональную кислоту (основание),
раствора сильного(ной) основания (кислоты) реакция кислотно-
основного взаимодействия протекает ступенчато. В начале реагирует более сильный компонент смеси. Это взаимодействие протекает до тех пор пока концентрации ионов гидроксония
(гидроксида), образующихся при диссоциации более сильного и более слабого компонента не будут равны. После достижения указанного момента одновременно взаимодействуют оба
www.mitht.ru/e-library

17
компонента. Оно протекает до полной нейтрализации более сильного компонента. После этого реагирует только оставшийся слабый компонент. Момент достижения каждого из указанных моментов, как и состав раствора, включая в них [H3O+],[OH-] и рН,
определяется силой и концентрацией каждого компонента смеси.
До начала совместного титрования происходит нейтрализация более сильного компонента смеси. Концентрацию ионов гидроксо-
ния (гидроксида) и рН рассчитывают как изложено в разделах 1.2.1.
и 1.2.2.
В момент начала совместной нейтрализации
Найдём степень нейтрализации (оттитрованности) 1*, более сильной кислоты НХ в смеси с более слабой HАn и общую концентрацию ионов гидроксония [H3O+]общ = [H3O+]HX + [H3O+]HAn в
момент, после которого начинается нейтрализация HAn. В этот момент концентрация ионов гидроксония, образующихся при
диссоциации каждой из оставшихся кислот, равны.
[ H3O+]HX = [H3O+]HАn (76).
Смесь сильной и средней по силе кислот, HX и HAn. При
Ка(HAn) = 10-2 10-4 указанное равенство, принимая во внимание уравнения (59-1) и (12-2), с учётом разбавления), преобразуется в выражение (76-1):
|
* |
0,5 Ka(HAn) |
(0,5 Ka(HAn)2 2 Ka(HAn) C(HAn) R |
|
C (HX) (1 1) R |
|
|
(76-1) |
|
|
2 |
|||
|
|
|
|
|
Из него после соответствующих преобразований получают уравнение для расчета степени нейтрализации сильной кислоты в момент, предшествующий началу совместного титрования.
www.mitht.ru/e-library

18
|
|
2 |
|
Ka(HAn) |
2 |
|
|
|
C(HX) |
|
|
|||
2C(HX) |
|
|
(2 |
|
|
) 1 |
2C(HX) (Ka(HAn) |
|
4C(HX) Ka(HAn) |
|
||||
|
|
C(T) |
|
C(T) |
|
|||||||||
|
C(HAn) |
|
|
|
|
|
2 |
|
|
|
|
|||
|
|
|
|
Ka(HAn)) 1 |
2(2C(HX) |
|
Ka(HAn) C(HAn) Ka(HAn) C(HX)) 0 |
(76 2) |
||||||
C(T) |
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Действительный корень данного уравнения является указанным значением степени нейтрализации. Он достаточно легко получается методами матричной алгебры с использованием общедоступных компьютерных программ, например, Mcad 8. Ниже приведена
матрица коэффициентов перед 1 .
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
2(2С(HX) |
Ka(HAn) C(HX) Ka(HAn) C(HAn)) |
|
|||||||||
|
|
|
||||||||||
|
|
|
C(HX) |
|
|
|
|
|
C(HAn) |
|
|
|
2C(HX) (Ka(HAn) |
4C(HX) Ka(HAn) |
Ka(HAn)) |
||||||||||
|
|
|||||||||||
|
|
|
C(T) |
|
|
|
|
C(T) |
|
|||
|
|
|
|
|
2 |
|
Ka(HAn) |
|
||||
|
|
|
2C(HX) |
|
(2 |
|
) |
|
|
|
||
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
C(T) |
|
||||
Концентрацию ионов Н3О+ при 1 рассчитывают по левой или
правой части уравнения (76-1).
[H3O ]общ [H3O ]HX |
[H3O ]HAn C (HX) (1 1 ) R, где R |
|
1 |
|
. |
|
C(HX) |
|
|||
|
1 |
* |
|||
|
C(T) |
||||
|
|
|
1 |
|
|
Смесь сильной и слабой кислот. При Ка < 10-4, равенство (76),
принимая во внимание (59-1) и (14-1), имеет более простую форму:
C (HX) (1 1) R 
 Ka C(HAn) R (78)
Ka C(HAn) R (78)
1 1 |
K |
a |
C(HAn) R |
(78-1) |
|
|
|
|
(HX) R |
||
|
C |
|
|||
Из них получают уравнение (78-2) для расчета 1*.
www.mitht.ru/e-library

19
|
2 |
|
|
K |
a |
(HAn) C(HAn) |
|
|
K |
a |
(HAn) C(HAn) |
|
|||
|
|
2 |
|
|
|
1 |
|
|
|
|
0(78 2) |
||||
|
|
|
|
|
|
|
2 |
||||||||
1 |
|
|
|
|
|
C(HX) C(T) |
|
1 |
|
|
|
C(HX) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Матрица коэффициентов этого уравнения имеет вид
|
Ka(HAn) C(HAn) |
|||
1 |
|
|
|
|
|
C(HX)2 |
|||
|
|
|
|
|
2 |
|
Ra(HAn) C(HAn) |
|
|
|
|
C(HX) C(T) |
|
|
|
1 |
|
|
|
|
|
|
||
|
|
|
|
|
Решение данной матрицы позволяет получить значение 1*.
Концентрация ионов Н3О+ рассчитывают, как и в предыдущем случае, по (77).
Смесь средних по силе кислот. Если Ka(HAn1) и Ka(HAn2) =
=10-2 10 –4 и Ka(HAn1) > Ka(HAn2), то равенство (76) при учете (72-1)
и (12-2) и разбавления преобразуется в (79).
|
|
|
|
|
0,5Ka(HAn2) |
(0,5Ka(HAn2) |
2 |
2Ka(HAn2) C(HAn2) R |
|
K |
a |
(HAn ) |
1 1 |
|
|
(79) |
|||
|
|
|
|
|
|||||
|
1 |
|
|
|
2 |
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
Из него получают (79-1) для расчета *. |
|
|
|
|
|||||||
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
C(HAn1) |
|
|
|
*3 |
|
|
|
|
|
K(HAn1) |
|
(2K(HAn1) K(HAn |
2)) 1 K(HAn1) (K(HAn1) 4K(HAn1) |
|
||||||||
C(T) |
|
|||||||||||
|
C(HAn1) |
|
|
C(HAn1) |
|
*2 |
|
|
C(HAn1) |
|
||
|
|
|
2K(HAn2) |
|
K(HAn2)) 1 |
K(HAn1) (2K(HAn1) |
|
|
|
|||
C(T) |
C(T) |
C(T) |
||||||||||
K(HAn2) 4K(HAn1)) 1* (K(HAn1)2 |
K(HAn2) C(HAn2)) 0 |
(79-1) |
|
|
||||||||
Алгебраическое решение его такое же как и (76-2).
Смесь средней и слабой или двух слабых кислот. Условие,
реализующееся в момент, предшествующий началу титрования более слабой из них, описывается более простым выражением (80),
чем в предыдущем случае.
www.mitht.ru/e-library
20
Ka |
1 1* |
|
|
|
|
(80) |
|
Ka |
C(HAn |
2) R |
|||||
* |
|||||||
1 |
|
|
2 |
|
|
||
|
1 |
|
|
|
|
|
|
Из него получают (80-1) для расчета * |
: |
|
|||||
|
|
|
|
1 |
|
|
|
|
2 |
|
C(HAn1) *3 |
|
2 |
|
|
2 |
|
C(HAn1) |
|
|
|||||
K(HAn1) |
|
|
|
1 |
(K(HAn1) |
|
2K(HAn1) |
|
|
|
|
K(HAn2) |
|
||||
|
C(T) |
|
|
C(T) |
|
(80-1) |
|||||||||||
|
|
|
*2 |
|
|
|
|
C(HAn1) |
|
|
|
|
2 |
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
C(HAn2)) 1 |
K(HAn1) (K(HAn1) |
|
K(HAn1) |
|
) K(HAn1) |
|
0 |
||||||||||
C(T) |
|
|
|||||||||||||||
Пример. 0,1000 М раствор янтарной кислоты HOOC(CH2)2COOH титруется 0,1200 М раствором КОН. Рассчитать рН раствора и степень оттитрованности кислоты по первой ступени, в момент, предшествующий началу титрования её по второй ступени. Ka1 1,6 10 5. Ka2 2,3 10 6.
Имеется слабая двухосновная кислота. Её можно рассматривать как смесь двух слабых одноосновных кислот с соответствующими константами кислотности. Уравнение (80-1) после подстановки соответствующих значений приобретает вид:
2,133 10-10 3 – 2,768 10-7 2 + 2,128 10-10 + 2,128 10-10 = 0
3 1,298 103 2 0,9976 0,9976 0
Полученное значение 1*, равное 0,033, показывает, что как только янтарная кислота будет нейтрализована по первой ступени на З,З% начнётся её нейтрализация по второй ступени, т.е. происходит одновременная нейтрализация по обеим ступеням.
HOOC(CH |
2 |
) |
2 |
COOH KOH HOOC(CH |
2 |
) |
2 |
COOK H |
2 |
O |
|
|
при * |
0,033 |
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
||||||||||
HOOC(CH |
2 |
) |
2 |
COOH 2KOH KOOC(CH |
2 |
) |
2 |
COOK 2H |
2 |
O |
при * |
0,033 |
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
||||||||||
Концентрация ионов гидроксония в таком растворе равна: |
|
|||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
[H3O |
|
]общ [H |
3O |
|
]1ст [H3O |
|
]2ст Ka1 |
1 1* |
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
* |
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
[H3O ]общ |
1,6 10 5 |
1 0,033 |
4,69 10 4 M |
|
|
|
|
|
pH = 3,32 |
|||||||||||||||||||||||||
|
|
|
|
|
|
|||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
0,033 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
В интервале |
значений |
|
|
* |
0,999 |
происходит совместная |
||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
нейтрализация обеих компонентов смеси. Степень нейтрализации
www.mitht.ru/e-library
