
Краткий курс органической химии. Часть 2
.pdf
достаточно сильными основаниями. Так, например, кислотно-основное равновесие в реакции ацетилена с гидроксидом калия сильно сдвинуто влево,
поскольку вода, как сопряженная гидроксид-аниону кислота, является более сильной (рКа 15,7), чем ацетилен.
CH C H + K
C H + K  OH
OH 
 CH
CH C
C K + H OH
K + H OH
ацетиленид
калия Поэтому для получения солей ацетилена (ацетиленидов) и алкинов с
концевой тройной связью их подвергают действию сильных оснований,
сопряженные кислоты которых являются более слабыми кислотами, чем алкины. Для этих целей используется, например, амид натрия.
CH C H + NaNH2 |
CH C Na |
+ |
NH |
|
|
3 |
Как кислота, ацетилен может реагировать также с магнийорганическими соединениями, так называемыми реактивами Гриньяра, с образованием ацетиленовых реактивов Гриньяра. Например, ацетилен реагирует с метилмагнийбромидом с образованием этинилмагнийбромида и метана.
Аналогично реагирует и 1-бутин с этилмагнийхлоридом.
|
|
|
|
|
|
|
|
|
|
|
|
||
CH |
|
C |
|
H + |
CH3 |
|
MgBr |
|
CH |
|
C |
|
MgBr + CH4 |
|
|
|
|
|
|||||||||
|
|
|
|
|
|
||||||||
|
|
|
|
|
|||||||||
CH3CH2C CH + CH3CH2MgCl
CH + CH3CH2MgCl  CH3CH2C
CH3CH2C CMgCl + CH3CH3
CMgCl + CH3CH3
2.2. Алкилирование ацетилена и алкинов с концевой тройной связью
Алкилирование – это замещение атома водорода на алкильный остаток.
Ацетилен проявляет очень слабые кислотные свойства, и подвижности атомов водорода недостаточно для непосредственного замещения на алкил. Поэтому алкилирование осуществляют двухстадийно: сначала отщепляют атом водорода в виде протона действием сильного основания, например, амида натрия, и
полученный при этом ацетиленид подвергают действию алкилгалогенида.
http://www.mitht.ru/e-library

NaNH2 |
|
|
X |
||
CH C Na |
R |
||||
CH CH _ |
NH3 |
_ |
|
CH C R |
|
|
|
|
NaX |
||
Полученный при алкилировании ацетилена алкилацетилен содержит еще один атом водорода при тройной связи, который аналогичным же образом может быть замещен на алкил – такой же или другой.
CH C R |
NaNH2 |
R C C Na |
R' X |
R C C R' |
_NH3 |
_NaX |
В качестве примера рассмотрим получение из ацетилена пропина и превращение последнего в 2-бутин.
|
|
|
|
|
|
|
NaNH2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3Br |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
CH |
|
|
CH |
CH |
|
C Na |
|
|
CH |
|
C |
|
|
CH3 |
|
|
|
|
|
|
||||||||||||||||||||||
|
|
_NH |
|
|
|
|
|
_NaBr |
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
CH3 |
|
|
C |
|
CH |
NaNH2 |
CH3 |
|
C |
|
|
|
|
|
|
|
|
|
CH3Br |
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
C Na |
|
|
|
|
CH |
|
C |
|
C |
|
CH |
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
_ NaBr |
|
|
|
|||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
_ NH |
|
|
|
|
|
|
|
|
|
|
|
|
3 |
3 |
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2.3. Реакции присоединения
Алкины как ненасыщенные соединения вступают в реакции присоединения.
Электрофильное присоединение для алкинов протекает труднее, чем для алкенов, поскольку в качестве интермедиатов здесь выступают винилкатионы, менее устойчивые реакционные частицы по сравнению с алкилкатионами.
Электрофильное присоединение брома происходит по механизму AdE,
аналогичному механизму присоединения брома к алкенам, через π-комплекс и катион бромония. Образующийся в результате стереоселективной реакции ненасыщенный дибромид имеет Е-конфигурацию.
R C CH Br2 R C CH |
|
|
R C=CH |
|
Br |
Br |
_ |
Br |
R C CH |
R C=CH |
|||
Br |
|
Br |
Br |
|
Br |
|
|
|
|
 Br
Br
Поскольку электрофильное присоединение к алкинам происходит медленнее, чем к алкенам, то в соединениях, содержащих и двойную, и
тройную связи, можно селективно осуществить присоединение только по
http://www.mitht.ru/e-library
двойной связи с сохранением тройной. Так, например, при взаимодействии 1-
пентен-4-ина с 1 эквивалентом брома образуется 4,5-дибром-1-пентин.
CH2=CHCH2C |
|
CH |
Br2 |
|
|
CH2 |
|
|
|
CHCH2C |
|
CH |
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|||||||||||
|
|
|
|||||||||||
|
|
||||||||||||
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
Br |
|
|
Br |
|||||
Электрофильное присоединение |
к |
несимметричным алкинам |
|||||||||||
несимметричных реагентов происходит региоселективно по правилу Марковникова, т.к. преимущественный продукт образуется через наиболее устойчивый катион. Например, присоединение хлороводорода к пропину приводит к 2-хлорпропену и далее к 2,2-дихлорпропану по следующему механизму. 

CH3 |
H |
Cl |
C CH |
|
|
CH3 C CH2 |
Cl |
CH3 C=CH2 |
|
C CH |
CH3 |
|
_Cl |
|
|||||
|
|
|
|
|
|
|
Cl |
||
|
|
|
H Cl |
|
|
|
|
||
|
H |
Cl |
Cl |
|
|
|
Cl |
Cl |
Cl |
CH |
C=CH |
|
|
CH |
C CH |
|
|||
C=CH |
CH |
|
_Cl |
|
CH3 C CH3 |
||||
3 |
2 |
3 |
2 |
3 |
3 |
|
|||
|
Cl |
|
H Cl |
|
|
|
|
|
Cl |
Как электрофильное присоединение происходит и реакция Кучерова – гидратация алкинов в кислой среде в присутствии солей ртути (II).
Образующийся при этом енол (спирт, в котором гидроксильная группа связана с атомом углерода при двойной связи) как нестабильное соединение изомеризуется в более устойчивое карбонильное соединение путем перемещения атома водорода от кислорода к углероду. Из ацетилена при гидратации по Кучерову образуется уксусный альдегид, из монозамещенных ацетиленов – кетоны, поскольку присоединение воды происходит по правилу Марковникова.
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
CH |
|
|
CH + H |
|
|
OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH2=CH |
|
OH |
|
|
|
|
|
|
|
|
CH3 |
|
CH |
|
O |
||||||||||||||||||||
|
|
|
|
|
HgSO4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
R |
|
|
|
|
|
|
|
|
|
|
|
R |
|
C=CH2 |
|
|
|
|
|
|
|
|
|
R |
|
C |
|
|
CH |
|||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
C CH + |
H OH |
|
HgSO |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4 |
|
|
|
|
|
|
OH |
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
Аналогично |
происходит |
|
и |
|
присоединение |
|
карбоновых |
|
кислот, |
|||||||||||||||||||||||||||||||||||||||||||||||
катализируемое солями ртути. Так, из ацетилена и уксусной кислоты
http://www.mitht.ru/e-library

получается винилацетат, а присоединение пропановой кислоты к пропину дает
изопропениловый эфир пропановой кислоты.
|
CH |
|
|
CH + CH |
|
C |
O |
|
|
Hg2 |
|
|
|
|
CH =CH |
|
O |
|
|
O |
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
C |
|
|
|
CH |
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||
|
|
|
|
|
|
|
3 |
|
|
|
H |
|
|
|
|
|
|
|
2 |
3 |
винилацетат |
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
||||||||||||
|
|
|
|
|
|
|
|
|
O |
|
Hg2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
CH |
|
C |
|
CH3 |
+ CH CH |
|
C |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH =C |
|
O |
|
C |
|
CH CH |
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||
|
|
|
|
|
|
|
3 |
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 3 |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
Присоединение синильной кислоты к ацетилену в присутствии хлорида меди (I) приводит к нитрилу акриловой кислоты (акрилонитрилу).
CuCl
CH CH + H CN
CH + H CN  CH2=CH CN
CH2=CH CN
HCl
В условиях свободно-радикальной реакции бромоводород присоединяется к алкинам с концевой тройной связью так же, как и к алкенам – против правила Марковникова (перекисный эффект). Так, при взаимодействии
1-бутина с бромоводородом в присутствии перекиси водорода в качестве главного продукта образуется 1-бром-1-бутен.
HBr
CH3CH2C CH H2O2
CH H2O2 CH3CH2CH=CHBr
CH3CH2CH=CHBr
Кроме электрофильного и свободно-радикального присоединения для алкинов, в отличие от алкенов характерны реакции нуклеофильного присоединения. В качестве примера приведем взаимодействие алкинов со спиртами в присутствии алкоголятов щелочных металлов в качестве катализаторов. Формально спирт как О-Н-кислота присоединяется к алкину по правилу Марковникова. При взаимодействии ацетилена с этанолом в присутствии этилата натрия образуется винилэтиловый эфир, а из 1-бутина и метанола в присутствии метилата натрия – 2-метокси-1-бутен.
|
|
|
|
|
|
|
|
|
C H ONa |
|
|
|
|
|
|
|
||||||||
CH |
|
CH + |
|
CH3CH2 |
|
O |
|
H |
2 |
5 |
CH =CH |
|
O |
|
|
|
CH CH |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
2 |
3 |
||||||||
|
|
|
|
|
|
|
|
|
|
|
CH3ONa |
|
|
|
|
|
|
|
||||||
CH3CH2 |
C |
|
CH |
+ CH3O |
|
H |
|
|
|
CH3CH2 |
|
C=CH2 |
|
|||||||||||
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
||||||||||||||||||
OCH3
http://www.mitht.ru/e-library
2.4. Реакции с альдегидами и кетонами
Кислотные свойства алкинов с концевой тройной связью позволяют этим соединениям вступать в реакции с карбонильными соединениями – альдегидами и кетонами.
Реакция Реппе. Ацетилен реагирует с формальдегидом в соотношении
1:2 в присутствии ацетиленида меди с образованием сначала 2-пропин-1-ола
(пропаргилового спирта), а затем 2-бутин-1,4-диола.
|
|
|
|
|
|
|
CuC |
|
CCu |
|
CH2=O |
|
|
|
||||||||||||
|
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
||||||||||||||||||||||
H |
|
C |
|
C |
|
H + CH2=O |
|
|
|
|
|
H |
|
C |
|
C |
|
CH2OH |
|
|
|
|
|
HOCH2C |
|
CCH2OH |
|
|
|
|
|
|
|
|
|
|
|
CuC |
|
CCu |
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
пропаргиловый спирт |
2-бутин-1,4-диол |
||||||||||||||
|
|
Реакция Фаворского. |
|
При нагревании |
кетона с |
алкином, имеющим |
||||||||||||||||||||
концевую тройную связь, в присутствии едкого кали в качестве катализатора образуются соответствующие алкинолы. Например, из ацетилена и ацетона в этих условиях получается 2-метил-3-бутин-2-ол.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|||||||||
|
|
|
|
|||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
CH |
|
C |
|
H |
+ CH3 |
CCH3 |
KOH, t |
|
CH |
|
C |
|
C |
|
|
|
CH3 |
|||||||||||||||
|
|
|
|
|
|
|||||||||||||||||||||||||||||
|
|
|
|
|
|
|
||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
||||||||||||
Взаимодействие метилфенилкетона и 1-бутина в аналогичных условиях |
||||||||||||||||||||||||||||||||||
приводит к 2-фенил-3-гексин-2-олу. |
|
|
|
|
|
|
|
|
|
|
|
CH3 |
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
KOH, t |
|
|
|
|
|
|
|
||||||||
|
|
|
C |
|
CH3 + CH |
|
CCH2CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
C |
|
C |
|
CCH2CH3 |
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
2.5. Восстановление и окисление алкинов
Каталитическое гидрирование алкинов на активных катализаторах, таких как платина, никель, палладий, приводит к насыщению тройной связи и образованию соответствующего алкана. Промежуточно образующийся алкен выделить невозможно, поскольку он в этих условиях очень быстро присоединяет водород и превращается в алкан.
R C C R' 2H2, Pt R CH2 CH2 R'
R CH2 CH2 R'
При гидрировании на дезактивированном («отравленном») палладии,
активность которого уменьшена определенными добавками, алкины
http://www.mitht.ru/e-library
восстанавливаются только частично, т.е. до алкенов. При этом присоединение обоих атомов водорода к атомам углерода тройной связи осуществляется синхронно с одной стороны (цис-присоединение), поэтому в случае алкенов,
для которых возможна стереоизомерия, образуется только алкен с цис-
конфигурацией. Широко применяется для этих целей так называемый катализатор Линдлара – нанесенный на какой-либо носитель палладий, «отравленный» каким-либо соединением свинца (II), например, палладий на карбонате кальция с добавлением оксида свинца.
R |
|
C |
|
C |
|
R' |
|
H2, Pd |
R |
R' |
|
|
|
|
|
C=C |
|||||||
|
|
|
|
|
|
|
|||||
|
|
|
CaCO3, PbO |
H |
|||||||
|
|
|
|
|
|
|
H |
||||
Алкины можно также восстанавливать до алкенов действием натрия в жидком аммиаке. При этом восстановление происходит тоже стереоселективно,
но с образованием в основном транс-алкена.
R |
|
C |
|
C |
|
R' |
Na, NH3(ж.) R |
H |
|
|
|
|
|
H |
C=C |
||||
|
|
|
|
||||||
|
|
||||||||
|
|
|
|
|
|
|
|
R' |
|
Окисление алкинов
Алкины окисляются сильными окислителями до карбоновых кислот.
R C C R' KMnO4 R COOH + R' COOH
Алкины с концевой тройной связью окисляются до карбоновой кислоты и
диоксида углерода.
R C CH KMnO4 R COOH + CO2
CH KMnO4 R COOH + CO2
3. Задачи и упражнения
1.Изобразите структурные формулы и назовите все алкины общей формулы
С6Н10.
2.Получите 1-бутин и 3-метил-1-пентин: а) дегидрогалогенированием подходящего вицинального дигалогенопроизводного; б)
дегидрогалогенированием подходящего геминального дигалогенопроизводного; в) алкилированием ацетилена.
http://www.mitht.ru/e-library
3.Из ацетилена и других необходимых реагентов получите: а) 1-пентин; б) 3-
фенил-1-пропин; в) 2-бутин; г) 2-гексин; д) 4-метил-2-пентин.
4.Превратите 1-бутен в 1-бутин и напишите для полученного алкина уравнения реакций со следующими реагентами: а) 1 эквивалент брома; б)
метилмагнийбромид; в) 2-бутанон в присутствии КОН; г) натрий в жидком аммиаке.
5.Превратите 1-пентен в 1-пентин и напишите для полученного алкина уравнения реакций со следующими реагентами: а) 1 эквивалент бромоводорода в присутствии перекиси водорода; б) амид натрия, затем метилиодид; в) метилфенилкетон в присутствии КОН; г) 1 экв. хлора.
6.Получите из ацетилена 3-гексин и напишите для полученного алкина уравнения следующих реакций: а) с хлороводородом; б) с водой в присутствии сульфата ртути; в) с пропиловым спиртом в присутствии пропилата натрия; г) с водородом на «отравленном» палладии в качестве катализатора.
7.Получите из ацетилена 2-бутин и напишите для полученного алкина уравнения следующих реакций: а) с 1 эквивалентом бромоводорода; б) с
натрием в жидком аммиаке; в) с уксусной кислотой; г) с 1 эквивалентом брома.
8.Из ацетилена и любых неорганических реагентов осуществите стереоселективный синтез: а) цис-3-гексена; б) транс-3-гексена.
http://www.mitht.ru/e-library
АРОМАТИЧЕСКИЕ УГЛЕВОДОРОДЫ
К ароматическим углеводородам относятся вещества, имеющие так называемый ароматический характер, являющийся отражением их специфического строения. Ароматический характер – это совокупность физических и химических свойств веществ, среди которых здесь уместно упомянуть только некоторые:
повышенная устойчивость, в том числе к окислителям;
низкая склонность к реакциям присоединения, несмотря на высокую степень ненасыщенности молекул;
склонность к реакциям замещения с сохранением ароматического строения.
Ароматические соединения подразделяются на бензоидные и
небензоидные ароматические соединения. Бензоидные ароматические соединения в свою очередь бывают моноядерные, имеющие в своем составе только одно бензольное кольцо (бензол, его гомологи и их производные), и
многоядерные (например, дифенил, нафталин и т.п.).
1. Строение бензола
Бензол представляет собой ненасыщенный углеводород состава С6Н6,
строение которого согласно современным представлениям не может быть адекватно описано какой-либо одной льюисовской структурной формулой.
Молекула бензола устроена следующим образом. Шесть атомов углерода,
входящих в цикл, имеют sp2-гибридизацию и лежат в одной плоскости. Три гибридные орбитали каждого атома углерода образуют две σ-связи,
связывающие этот атом с двумя другими атомами углерода, и σ-связь с атомом водорода. Негибридная р-орбиталь каждого атома углерода перекрывается одновременно с р-орбиталями двух соседних атомов углерода. Поскольку происходит боковое перекрывание орбиталей, то образуется замкнутая π-
электронная плотность над и под плоскостью σ-связей. Таким образом, связи между атомами углерода не являются ни простыми, ни двойными. π-
Электронная плотность не локализована между конкретными парами атомов
http://www.mitht.ru/e-library
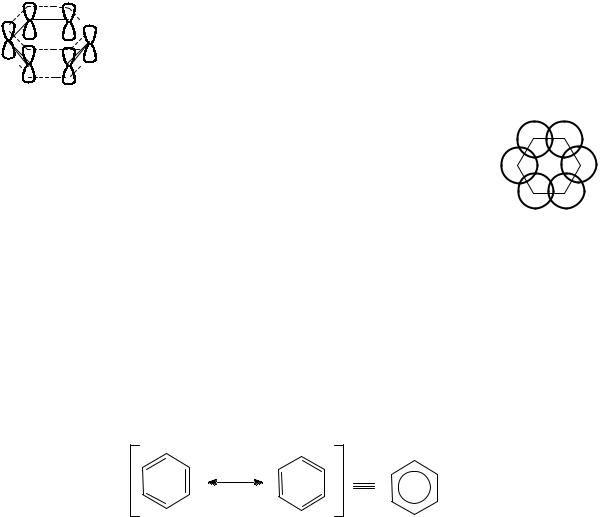
углерода в виде трех π-связей, а делокализована, т.е.






 распределена между всеми шестью атомами углерода
распределена между всеми шестью атомами углерода












 равномерно в виде единой круговой сопряженной системы из шести π-электронов.
равномерно в виде единой круговой сопряженной системы из шести π-электронов.
Проекция модели молекулы бензола с перекрытыми р-
орбиталями на плоскость, параллельную плоскости молекулы,
может быть представлена следующим образом:
Такое электронное строение молекулы бензола делает невозможным описание структуры бензола классическими формулами с локализованными связями типа формулы Кекуле. Поэтому молекулу бензола описывают либо набором двух канонических структурных формул, либо резонансным гибридом этих двух структур, т.е. мезомерной формулой, в
которой вписанная в правильный шестиугольник окружность символизирует делокализованную π-электронную плотность.
граничные структуры мезомерная структура
Делокализация электронной плотности в молекуле бензола приводит к повышенной стабильности бензола по сравнению с гипотетической молекулой циклогексатриена с локализованными двойными связями. Разница величин потенциальных энергий такой гипотетической (не существующей в реальности)
молекулы циклогексатриена и реальной молекулы бензола составляет около 36
ккал/моль. Эту величину называют энергией делокализации.
2. Номенклатура бензоидных ароматических соединений
Для бензола в номенклатуре ИЮПАК сохраняется его тривиальное название. Гомологи бензола называют, располагая перед основой бензол
названия имеющихся в молекуле заместителей и указывая их положение локантом (для дизамещенных производных бензола используется также
http://www.mitht.ru/e-library

обозначение взаимного положения частицами орто-, мета-, пара-). Для
некоторых гомологов бензола часто используются тривиальные названия.
|
|
|
CH3 |
CH3 |
CH2CH3 |
CH3 |
CH3 |
|
|
CH3 |
|
|
|
CH3 |
CH3 |
метилбензол этилбензол 1,2-диметилбензол 1,3-диметилбензол 1,4-диметилбензол
(толуол) |
(орто-ксилол) |
(мета-ксилол) |
(пара-ксилол) |
Из функциональных производных бензола приведем некоторые важные соединения, имеющие тривиальные названия:
NH2 |
OH |
CH=O |
C=O |
C=O |
|
|
|
OH |
CH3 |
анилин |
фенол |
бензальдегид |
бензойная ацетофенон |
|
|
|
кислота |
3. Получение бензола и его гомологов
Бензол и его гомологи содержатся в некоторых сортах нефти, откуда они могут быть выделены. Кроме того, эти ароматические углеводороды содержатся в каменноугольной смоле, получаемой при коксовании каменного угля. Ароматические углеводороды получают также при переработке нефтяных фракций в процессе ароматизации содержащихся в них нециклических и циклических насыщенных углеводородов (каталитический реформинг). На специальных катализаторах происходит циклизация и дегидрирование, как,
например, при образовании орто-ксилола из октана.
|
CH2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH2 |
CH2 |
|
|
CH3 |
Pt/Al O |
|
|
|
CH |
|
|
|
|
|
|
CH |
||
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
2 3 |
|
|
3 |
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
_H2 |
|
|
|
|
|
|
|
|
|
|
3 |
|
|
CH2 |
CH2 |
|
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
||
|
CH3 |
|
_3H2 |
|
|
|
CH |
||||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|||||||||||||||
|
CH2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
октан 1,2-диметилциклогексан орто-ксилол Циклотримеризацией ацетилена при нагревании под давлением на
угольном катализаторе можно получить бензол, а из других алкинов с конечной
http://www.mitht.ru/e-library
