
Краткий курс органической химии. Часть 2
.pdf
выгодной в этом случае будет та конформация, в которой экваториальное положение будет занимать изопропильная группа как более объемный заместитель, потому что ее аксиальное расположение вызывает более сильные
1,3-диаксиальные взаимодействия, чем аксиальное расположение менее
объемной метильной группы.
CH(CH3)2 H3C



 CH3
CH3 




 CH(CH3)2
CH(CH3)2
цис-1-изопропил-2-метилциклогексан Для анализа конформационного равновесия других производных
циклогексана используются аналогичные рассуждения.
2. Способы получения
Для получения циклоалканов из их функциональных производных могут быть использованы аналогичные превращения производных ациклических углеводородов (см. Способы получения алканов). Так, при восстановлении циклопентанона по Клемменсену или Кижнеру-Вольфу образуется циклопентан. Циклогексан и его гомологи могут быть получены каталитическим гидрированием ароматических углеводородов.
Zn/Hg
 O
O
HCl

 R 3H2, Pt
R 3H2, Pt 
 R
R
Кроме того, для получения циклических углеводородов или их производных существуют методы циклизации нециклических соединений.
А. Внутримолекулярная циклизация
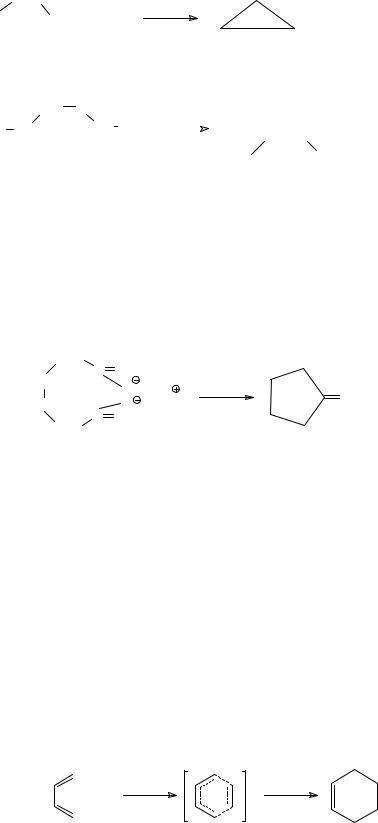
Реакция Вюрца Этот метод пригоден для получения малых циклов: циклопропана и
циклобутана. Подходящее дигалогенопроизводное подвергают воздействию натрия или цинка, и происходит образование связи между атомами углерода, от которых отщепляются атомы галогена.
http://www.mitht.ru/e-library
|
CH2 |
|
|
|
|
|
|
Na |
|
|
|
|
|
|
|
CH2 |
|
CH |
|
CH2CH3 _ |
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
CH CH |
|||||
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|||||
Br |
Br |
2NaBr |
|
|
|
2 3 |
||||||||
|
|
|
|
|
|
|
||||||||
1,3-дибромпентан |
|
|
этилциклопропан |
|||||||||||
|
|
CH2 CH2 |
|
Zn |
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||||
CH3 CH |
|
|
|
|
CH CH3 |
|
|
|
|
|
|
|||
|
|
|
|
|
_ZnCl2 |
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Cl |
|
|
|
Cl |
|
|
CH3 |
|
CH3 |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
2,5-дихлоргексан |
|
1,2-диметилциклобутан |
|||||||||||
Пиролиз кальциевых солей дикарбоновых кислот
Эта реакция используется для получения циклов, содержащих от пяти до семи атомов углерода. Например, при пиролизе кальциевой соли адипиновой
(гександиовой) кислоты с отщеплением карбоната кальция образуется
циклопентанон. |
CH2 |
C O |
|
|
|
|
|
CH2 |
|
|
|
|
|
|
O |
Ca2 |
_ |
t |
O |
|
|
CH |
O |
CaCO3 |
|||
|
2 |
C O |
|
|
|
|
|
CH2 |
|
|
|
|
Б. Межмолекулярная циклизация
Из реакций межмолекулярной циклизации остановимся только на реакции Дильса – Альдера, которая служит прекрасным методом для создания шестичленных циклических углеводородов и их производных. Эту реакцию также часто называют диеновой конденсацией, или диеновым синтезом. При нагревании сопряженных диеновых углеводородов с алкенами происходит взаимодействие трех π-связей, которое приводит к образованию двух новых σ-
связей, замыкающих цикл, и одной π-связи между С2- и С3-атомами бывшей диеновой системы. Например, взаимодействие 1,3-бутадиена с этиленом при нагревании под давлением приводит к образованию циклогексена.
+ 

переходное состояние Еще лучше, чем простые алкены, в эту реакцию вступают производные
алкенов, в которых двойная связь сопряжена с электроноакцепторными
http://www.mitht.ru/e-library
группами, проявляющими –М-эффект. Так, при нагревании под давлением 1,3-
бутадиена с пропеналем (акролеином) образуется 3-циклогексенкарбальдегид.
CH=O t, p  CH=O +
CH=O + 


3. Особенности химического поведения
Для устойчивых циклоалканов характерно химическое поведение,
свойственное алканам. Так, циклогептан и циклогексан вступают в реакции свободно-радикального замещения, такие как галогенирование (хлорирование и бромирование) на свету, сульфохлорирование, нитрование, дегидрирование,
например:
Cl2 |
Cl |
h |
|
хлорциклогексан
CH3 |
CH3 |
HNO3 |
|
|
NO2 |
1-метил-1-нитроциклопентан Однако циклопропан, который из-за своего строения является достаточно
напряженным соединением, больше склонен не к реакциям замещения, а к реакциям присоединения с раскрытием цикла. Он достаточно легко при умеренном нагревании подвергается гидрогенолизу при каталитическом гидрировании с образованием пропана.
H2, Ni
50oC CH3 CH2 CH3
CH3 CH2 CH3
При нагревании с бромом циклопропан образует 1,3-дибромпропан – продукт присоединения атомов брома по месту разрыва цикла.
Br2
t
 CH2 CH2 CH2
CH2 CH2 CH2
Br Br
Кроме того, циклопропан присоединяет галогеноводороды с образованием пропилгалогенидов, например, 1-хлорпропан в реакции с хлороводородом.
HCl
CH3 CH2 CH2
Cl
http://www.mitht.ru/e-library
4. Задачи и упражнения
1.Изобразите формулы следующих соединений: а) метилциклопропан; б) цис- 1-метил-2-этилциклопропан; в) транс-1,3-диметилциклогексан; г) 1,1-
диметилциклобутан.
2.Изобразите формулы и назовите все возможные изомеры циклического строения общей формулы С5Н10.
3.Изобразите конформационное равновесие и укажите наиболее устойчивую конформацию для следующих соединений: а) этилциклогексан; б) 1-
изопропил-1-метилциклогексан; в) цис-1-трет-бутил-2-метилциклогексан;
г) транс-1,4-диметилциклогексан; д) цис-1-втор-бутил-3-метилциклогексан;
е) транс-1-трет-бутил-3-метилциклогексан.
4.Из соответствующего дигалогеналкана получите 1,2,3-триметилциклопропан и напишите для него уравнения следующих реакций: а) с бромом при нагревании; б) с бромоводородом; в) с водородом на никеле.
5.Из соответствующего дигалогеналкана получите следующие соединения: а)
метилциклопропан; б) 1,1-диметилциклобутан; в) 1-метил-2-
этилциклопропан; г) 1-изопропил-3-этилциклобутан.
6.Используя пиролиз кальциевой соли дикарбоновой кислоты, осуществите получение циклогексана и напишите для него уравнения следующих реакций: а) с азотной кислотой; б) с бромом при освещении; в)
дегидрирования.
7.Используя пиролиз кальциевой соли дикарбоновой кислоты, осуществите получение циклопентана и напишите для него уравнения следующих реакций: а) с диоксидом серы и хлором при освещении; б) с хлором при освещении; в) дегидрирования.
http://www.mitht.ru/e-library

АЛКЕНЫ
1. Строение и номенклатура
Алкены – это ненасыщенные углеводороды, содержащие двойную связь.
Общая формула ациклических алкенов СnН2n.
Атомы углерода, связанные двойной связью, находятся в sp2-
гибридизации. Гибридные орбитали при осевом перекрывании образуют σ-
связь, а негибридные р-орбитали при боковом перекрывании – π-связь.
Простейшим представителем алкенов является этилен СН2=СН2.
Согласно правилам номенклатуры ИЮПАК наличие в молекуле углеводорода двойной связи отражается в названии соединения суффиксом ненасыщенности
-ен. По правилу наименьших локантов нумерацию главной цепи, которая обязательно должна содержать двойную связь, производят с того конца, к
которому ближе двойная связь.
CH3CH=CHCH2CH2CH3 |
CH2=CHCH2 |
|
|
CH3 |
|
|
|
||
|
CHCHCH3 |
|||
|
||||
|
|
|
CH3 |
|
2-гексен |
4,5-диметил-1-гексен |
|||
Для алкенов, у которых атомы углерода двойной связи имеют по два разных заместителя, возможна пространственная изомерия, связанная с различной конфигурацией двойной связи. Так, например, для структуры 2-
бутена, у которого атомы углерода двойной связи имеют в качестве заместителей атом водорода и метильную группу, возможно существование двух пространственных, или геометрических, изомеров с различным расположением атомов водорода относительно двойной связи. Одну из конфигураций, в которой атомы водорода расположены по одну сторону двойной связи, традиционно называют цис-конфигурацией, а вторую – с
расположением атомов водорода по разные стороны двойной связи – транс-
конфигурацией. |
CH3 |
CH3 |
CH3 |
H |
|
|
C=C |
|
C=C |
|
H |
H |
H |
CH3 |
|
цис-2-бутен |
транс-2-бутен |
||
|
или (Z)-2-бутен |
или (Е)-2-бутен |
||
http://www.mitht.ru/e-library

Вобщем случае конфигурацию двойной связи обозначают буквами Е и Z
взависимости от взаимного расположения старших заместителей при каждом атоме углерода двойной связи. Если старшие заместители при каждом из атомов углерода двойной связи расположены по одну сторону от двойной связи, такую конфигурацию обозначают буквой Z (от немецкого zusammen –
вместе); когда же старшие заместители расположены по разные стороны двойной связи, конфигурацию обозначают буквой E (от немецкого entgegen –
напротив). Поэтому транс-2-бутен может быть также назван (Е)-2-бутен, а цис- 2-бутен – (Z)-2-бутен. Старшинство заместителей определяют по известным правилам (см. раздел 5.2.2.). Ниже приведен еще один пример стереоизомеров с различной конфигурацией двойной связи.
CH3CH2 |
CH3 |
CH3CH2 |
CH(CH3)2 |
H |
C=C |
H |
C=C |
CH(CH3)2 |
CH3 |
(Е)-2,3-диметил-3-гексен (Z)-2,3-диметил-3-гексен
2. Способы получения
2.1. Дегидрирование алканов
При нагревании алканов на таких катализаторах, как оксид хрома (III) и
др., происходит дегидрирование с образованием алкенов. Так, например, при дегидрировании бутана образуется смесь 1-бутена и 2-бутена.
CH3CH2CH2CH3 |
Cr2O3, t |
CH2=CHCH2CH3 |
+ CH CH=CHCH |
||
_H |
|||||
|
|
3 |
3 |
||
|
2 |
|
|
|
|
2.2. Дегидрогалогенирование галогеналканов
При нагревании галогенопроизводных алканов с сильными основаниями,
такими как гидроксид калия в этиловом спирте, происходит дегидрогалогенирование – отщепление атома галогена и атома водорода от соседнего атома углерода – с образованием двойной связи между этими атомами углерода. Например, из этилхлорида при этом получается этилен.
|
CH2 |
|
|
CH2 + KOH |
|
C2H5OH |
|
CH2=CH2 + KCl + H2O |
|
||||||||
|
|
|
t |
|||||
|
|
|
|
|||||
H |
|
Cl |
|
|
||||
|
|
|
|
|
||||
http://www.mitht.ru/e-library

При наличии двух соседних атомов углерода, имеющих различное
количество атомов водорода, отщепление атома водорода
преимущественно происходит от наименее
гидрогенизированного атома углерода (правило Зайцева),
т.е. от того соседнего атома углерода, который связан с меньшим количеством атомов водорода. Таким образом, реакция дегидрогалогенирования протекает региоселективно: из двух возможных структурных изомеров один алкен образуется преимущественно. Так, при нагревании 2-хлорбутана с гидроксидом калия в этаноле в качестве главного продукта образуется 2-бутен. Его структурный изомер – 1-бутен – образуется в значительно меньшем количестве.
CH3CHCH2CH3 |
|
KOH, t |
|
CH3CH=CHCH3 |
||
C2H5OH |
||||||
|
|
|
||||
Cl |
|
|||||
|
|
|
|
|||
2.3.Дегидратация спиртов
Дегидратацию спиртов с образованием алкенов можно осуществить либо в жидкой фазе – нагреванием спирта с каталитическим количеством сильной кислоты, например, серной, либо в газовой фазе, пропуская пары спирта над подходящим катализатором, например, оксидом алюминия. Так, при нагревании этилового спирта с каталитическим количеством серной кислоты образуется этилен, а при пропускании нагретых до высокой температуры паров
2-пропанола над оксидом алюминия получается пропен.
|
|
|
CH2 |
|
|
CH2 |
|
H , t |
CH2=CH2 + H2O |
|||||
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|||||
|
H |
|
|
|
|
OH |
|
|
|
|
||||
|
CH2 |
|
|
CH |
|
CH3 |
|
Al2O3, t |
CH2=CHCH3 + H2O |
|||||
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||||
H |
OH |
|
|
|
|
|||||||||
Для дегидратации спиртов также справедливо правило Зайцева, в
соответствии с которым отщепление воды от спиртов происходит
региоселективно, т. е. атом водорода отщепляется от наименее гидрогенизированного атома углерода. Например, при нагревании 2-метил-2-
бутанола с концентрированной серной кислотой в качестве катализатора образуется главным образом 2-метил-2-бутен, поскольку атом водорода
http://www.mitht.ru/e-library

отщепляется от менее гидрогенизированной (по сравнению с метильной)
метиленовой группы.
|
CH3 |
|
|
|
|
|
|
CH3 |
|
|
H , t |
||||||||
CH3 |
|
CCH2CH3 |
CH3 |
C=CHCH3 + H2O |
|||||
|
|
|
|
|
|
||||
|
|
|
|
|
|
||||
|
OH |
|
|
|
|
|
|
|
|
2.4.Дегалогенирование вицинальных дигалогеналканов
Алкены можно получить из вицинальных дигалогеналканов действием на них металлического цинка. Так, например, из 1,2-дихлорбутана получается 1-
бутен, а из 1,2-дибромциклогексана – циклогексен.
|
CH2 |
|
|
CHCH2CH3 |
|
Zn |
|||||||
|
|
|
|
|
|
CH2=CHCH2CH3 |
|||||||
|
|
|
_ |
|
|||||||||
|
|
|
|
|
|
|
ZnCl2 |
||||||
Cl |
|
Cl |
|||||||||||
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
Br |
Zn |
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
Br |
_ZnBr |
2 |
|
|
|
|
||
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
||
3. Химические свойства
3.1. Реакции электрофильного присоединения
Алкены как ненасыщенные соединения вступают в реакции присоединения. По способу разрыва связи эти реакции могут быть как гомолитическими, так и гетеролитическими. В нормальных условиях обычно протекают гетеролитические реакции присоединения, причем из-за нуклеофильного характера двойной связи для обычных алкенов наиболее характерны реакции электрофильного присоединения (AdE), в которых алкены выступают как доноры электронной пары π-связи. Донорные свойства алкенов зависят от величины электронной плотности на двойной связи, поэтому чем больше алкильных заместителей имеется при атомах углерода двойной связи,
тем выше реакционная способность алкена в реакциях электрофильного присоединения. Например, пропен более реакционноспособен, чем этилен, а 2-
метилпропен реакционноспособнее, чем пропен.
3.1.1.Взаимодействие с галогенами
Алкены легко вступают в реакцию с галогенами, образуя вицинальные
дигалогеналканы. Обесцвечивание раствора брома является качественной
http://www.mitht.ru/e-library
реакцией, позволяющей обнаруживать ненасыщенные соединения, в том числе
и алкены. |
CH2=CH2 |
Br2 |
|
CH2 |
|
|
CH2 |
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
Br |
|
Br |
||
Реакция протекает в обычных условиях как электрофильное присоединение, причем связи атомов углерода с атомами брома образуются последовательно. Реакция начинается с электрофильной атаки двойной связи алкена электрофильным концом поляризованной молекулы брома с образованием так называемого π-комплекса, в котором компоненты слабо связаны лишь электростатическими силами. Затем происходит гетеролитический разрыв π-связи и связи бром-бром и образование связи между атомом углерода и атомом брома за счет взаимодействия заполненной орбитали атома углерода и вакантной орбитали атома брома. Поскольку второй атом углерода теряет электрон бывшей π-связи, на нем возникает положительный заряд. Образовавшийся карбокатион превращается в циклический катион бромония, который подвергается нуклеофильному раскрытию бромид-анионом с образованием продукта реакции.
CH2=CH2 |
Br2 |
CH2=CH2 |
|
|
Br |
Br |
|
CH2 CH2 |
CH2 CH2 |
||||
|
_Br |
CH2 CH2 |
||||
|
|
Br |
Br |
Br |
Br |
|
|
|
Br |
|
|
|
|
|
|
π-комплекс |
|
катион бромония |
|
|
Такой механизм реакции подтверждается стереохимическим результатом
присоединения брома, когда в результате образуются асимметрические атомы углерода. Атака бромид-анионом при раскрытии катиона бромония происходит стереонаправленно с противоположной уже присоединенному атому брома стороны, так что атомы брома оказываются по разные стороны от плоскости исходной двойной связи. Так, например, взаимодействие брома с циклопентеном приводит к образованию транс-1,2-дибромциклопентана.
Br2 |
Br |
|
Br |
http://www.mitht.ru/e-library

Взаимодействие алкенов с хлором происходит аналогично реакции с бромом, т.е. образуются вицинальные дихлориды.
Если же проводить взаимодействие алкена с галогеном, например, с
хлором в воде как растворителе, то в качестве главного продукта получаются вицинальные галогеноспирты (галогенгидрины). Так в реакции этилена с хлором в воде образуется 2-хлорэтанол (этиленхлоргидрин).
Cl2
CH2=CH2  CH2 CH2
CH2 CH2
H2O Cl OH
Это взаимодействие алкенов с галогенами в воде называют реакцией гипогалогенирования, поскольку она формально является реакцией присоединения к алкену кислот НО-Х, которые образуются в водных растворах галогенов. К несимметричным алкенам эти кислоты присоединяются региоселективно в соответствии с полярностью разрывающихся связей,
например:
|
|
|
|
|
|
|
|
|
|
|
||||
HO |
|
|
|
|
|
|
|
|
|
|
||||
CH2=CH |
|
CH3 |
Cl |
CH |
|
CH |
|
CH |
||||||
|
|
|
|
|
|
|
|
|||||||
|
|
|
(Cl2,H2O) |
|
2 |
|
3 |
|||||||
|
|
|
Cl |
|
OH |
|||||||||
|
|
|
|
|
|
|
|
|
||||||
3.1.2.Присоединение галогеноводородов
Алкены легко реагируют с галогеноводородами, давая продукты
присоединения. Так, например, при взаимодействии этилена с хлороводородом образуется хлорэтан.
CH2 |
|
CH2 + H |
|
Cl |
|
CH3 |
|
|
CH2 |
|
|||||||||
|
|
|
|
||||||
|
|||||||||
|
|
|
|
||||||
|
|
|
|
|
|
|
|
Cl |
|
Присоединение галогеноводородов |
к несимметричным алкенам |
||||||||
происходит региоселективно в соответствии с правилом Марковникова,
который обнаружил, что атом водорода из молекулы галогеноводорода присоединяется к наиболее гидрогенизированному атому углерода двойной связи. Это можно проиллюстрировать на примере реакции пропена с бромоводородом, в результате которой в качестве главного продукта образуется 2-бромпропан, а не 1-бромпропан.
CH3 |
|
CH |
|
CH2 + H |
|
Br |
|
CH3 |
|
|
CH |
|
CH3 |
|
|||||||||||||
|
|
|
|
|
|
||||||||
|
|||||||||||||
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
Br |
|||
http://www.mitht.ru/e-library
