
- •Модуль 1 атомно-молекулярне вчення. Класифікація неорганічних сполук
- •1.1. Основні поняття та закони хімії
- •1.1.1. Ключові положення атомно-молекулярного вчення
- •1.1.2. Поняття загальної хімії
- •1.1.3. Фізичні величини, що застосовуються в хімії
- •Моль – це кількість речовини, яка містить стільки часток – структурних елементів, скільки атомів міститься в ізотопі Карбону с12 масою 0,012 кг.
- •1.1.4. Основні закони хімії
- •М.В. Ломоносов
- •Ж. Пруст
- •Наприклад, у реакції
- •А. Авогадро
- •2) Фактор еквівалентності може дорівнювати 1 і бути меншим за 1.
- •Підсумки Необхідно зрозуміти
- •Треба вміти
- •Слід запам’ятати
- •1.2. Основні класи неорганічних сполук
- •1.2.1. Класифікація неорганічних сполук
- •1.2.2. Оксиди
- •1.2.3. Основи
- •1.2.4. Кислоти
- •1.2.6. Генетичний зв’язок між класами неорганічних сполук
- •Класами неорганічних сполук
- •Підсумки
- •Задачі для самостійного розв’язування
- •Модуль 2 будова речовини
- •2.1. Будова атома
- •2.1.1. Складність будови атома та її експериментальне доведення
- •2.1.2. Перші моделі атома
- •Е. Резерфорд
- •2.1.3. Атомні спектри
- •2.1.4. Квантова теорія світла
- •2.1.5. Основні положення теорії будови атома Бора
- •2.1.6. Хвильова природа електрона. Електронні хмари
- •2.1.7. Квантові числа
- •Орієнтація s-, p- I d-орбіталей
- •2.1.8. Принцип Паулі
- •2.1.9. Послідовність заповнення електронами енергетичних рівнів у багатоелектронних атомах
- •Підсумки
- •Д. І. Менделєєв
- •2.2.3. Періодичність властивостей хімічних елементів
- •Спорідненістю до електрона (f) називається енергетичний ефект процесу приєднання електрона до нейтрального атома е з перетворенням його на негативний іон е-:
- •Підсумки
- •2.3.1. Іонний зв’язок
- •2.3.2. Ковалентний зв’язок
- •І електронів у молекулі водню н:h
- •Підсумки
- •Задачі для самостійного Розв’язування
- •Модуль 3 Закономірності перебігу хімічних реакцій
- •3.1.Хімічна термодинаміка
- •3.1.1. Теплові ефекти. Внутрішня енергія та ентальпія
- •Термодинаміки
- •Г. І. Гесс
- •1. Тепловий ефект хімічної реакції дорівнює сумі теплових ефектів її проміжних стадій.
- •3. Тепловий ефект хімічної реакції дорівнює різниці між сумою теплот утворення продуктів реакції і сумою теплот утворення вихідних речовин з урахуванням числа молів цих речовин.
- •3.1.2. Напрямленість процесів. Ентропія. Ізобарно-ізотермічний потенціал
- •Підсумки Необхідно зрозуміти
- •Треба вміти
- •Слід запам’ятати
- •3.2. Хімічна кінетикА та рівновага
- •3.2.1. Предмет хімічної кінетики
- •3.2.2. Швидкість хімічних реакцій
- •Речовин під час перебігу реакції
- •Залежність швидкості реакції від концентрації реагуючих речовин закон діючих мас
- •3.2.4. Вплив температури на швидкість реакцій. Енергія активації
- •3.2.5. Каталіз
- •3.2.6. Хімічна рівновага
- •Оборотної реакції
- •Підсумки Необхідно зрозуміти
- •Треба вміти
- •Слід запам’ятати
- •Приклади розв’язування задач
- •V(t2)моль/лхв.
- •Задачі для самостійного розв’язування
- •Модуль 4 Розчини. Теорія електролітичної дисоціації
- •4.1. Основні поняття про розчини
- •4.1.1. Термінологія, що використовується в теорії розчинів
- •4.1.2. Концентрація розчинів та способи її вираження
- •4.1.3. Колігативні властивості розчинів. Осмос
- •Підсумки Необхідно зрозуміти
- •Треба вміти
- •Слід запам’ятати
- •4.2. Теорія електролітичної дисоціації
- •4.2.1. Теорія електролітичної дисоціації Арреніуса
- •4.2.2. Реакції в розчинах електролітів. Іонні рівняння
- •4.2.3.Константа електролітичної дисоціації
- •4.2.4. Властивості розчинів сильних електролітів
- •4.2.5. Добуток розчинності
- •4.2.6. Дисоціація води. Іонний добуток води. Водневий показник
- •Підсумки Необхідно зрозуміти
- •Треба вміти
- •Слід запам’ятати
- •4.3. Гідроліз
- •4.4. Окисно-відновні реакції
- •Практичні заняття приклади розв’язування задач (до розділу 4.14.2)
- •Задачі для самостійного розв’язування
- •Приклади розв’язування задач (до розділу 4.3)
- •4. Розрахувати рН середовища під час взаємодії з водою амоній ціаніду.
- •Задачі для самостійного розв’язування
- •Приклади розв’язування задач (до розділу 4.4)
- •2. Підібрати коефіцієнти у схемі окисно-відновної реакції
- •Задачі для самостійного розв’язування
- •Предметний покажчик
- •Список рекомендованої літератури
1.2.6. Генетичний зв’язок між класами неорганічних сполук
Між простими речовинами та їх похідними – оксидами, кислотами, гідроксидами, солями існує взаємозв’язок, який визначає можливість їх взаємних перетворень. Його можна подати схемою (рис. 4).
Н
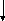 ЕМЕТАЛ
МЕТАЛ
ЕМЕТАЛ
МЕТАЛ
Кислотний оксид Вода
Основний оксид
+ +






Кислота
Основа
+


Сіль
Рис. 4. Генетичний зв’язок між найважливішими
Класами неорганічних сполук
Наведемо конкретний приклад, запишемо формулу води у вигляді НОН:
S Ca
SO3 + HOH + CaO
H2SO4 + Ca(OH)2
CaSO4
Порівнюючи формули кислоти й води, можна зробити висновок, що кислота утворюється заміною гідроксильної групи у воді на кислотний залишок. Аналогічно основа утворюється заміною атома Гідрогену у воді на метал, а сіль — заміною атомів Гідрогену в кислоті на метал або гідроксильної групи в основі на кислотний залишок, або гідроксильної групи води на кислотний залишок, а атома Гідрогену на метал.
Підсумки
Необхідно зрозуміти
Усі неорганічні речовини поділяють на прості та складні.
До складних речовин належать оксиди, кислоти, основи, солі.
Назва складної речовини являє собою назву катіона й аніона.
Треба вміти
Розрізняти класи неорганічних сполук.
Записувати рівняння хімічних реакцій, що характеризують властивості різних класів неорганічних сполук.
Слід запам’ятати
Визначення класів неорганічних сполук.
Хімічні властивості різних класів неорганічних сполук.
ПРИКЛАДИ РОЗВ’ЯЗУВАННЯ ЗАДАЧ
1. Маса атома Карбону дорівнює 1,99310-26 кг, маса атома Сульфуру – 5,323810-26. Розрахувати відносну атомну масу Сульфуру.
Розв’язання
1/12 ma(C12)= 1,6610-27 кг
![]() .
.
Таким чином, відносна атомна маса Сульфуру становить 32,06.
2. Обчислити молярну масу сірки, якщо середня маса її молекули дорівнює 5,323810-23 г.
Розв’язання
M(S) = maNA = 5,323810-23г 6,0221023 моль-1 = 32,06 г/моль.
Таким чином, молярна маса сірки дорівнює 32,06 г/моль.
Визначити еквівалентні числа для хлору, азоту, вуглецю та фосфору, застосовуючи масові співвідношення, наведені далі:
|
Реакція H2 + A |
m(H2) : m(A) |
Реакція A + O2 |
M(A) : m(O2) |
|
H2 + Cl2 = 2HCl |
1 : 35,5 |
2H2 + O2 = 2H2O |
1 : 8 |
|
3H2 + N2 = 2NH3 |
1 : 4,7 |
C + O2 = CO2 |
3 : 8 |
|
2H2 + C = CH4 |
1: 3 |
P4 + 5O2 = P4O10 |
6,2 : 8 |
Розв’язання
Для хлору реальна частинка (молекула) має масу M(Cl2)=71, у даній реакції m(Cl2) = 35,5, тобто це вдвічі менше за реальну частинку. Таким чином, z(Cl2)=2.
Для азоту М(N2) = 28; 28/4,7 = 6, таким чином, z(N2) = 6.
M(C) = 12; 12/3 = 4, z(C) = 4.
M(O2) = 32; 32/8 = 4, z(O2) = 4.
M(P4)= 124; 124/6,2=20, z(P4)=20.
Таким чином, еквівалентні числа для хлору, азоту, вуглецю та фосфору дорівнюють відповідно 2, 6, 4, 20 .
4. Визначити масову частку Карбону в метані.
Розв’язання
![]()
![]()
Ar(C) = 12;
Mr(CH4) = 12 + 41 = 16;
![]()
Таким чином, масова частка Карбону в метані становить 75%.
5. Визначити число атомів Оксигену, що містяться в 320 г кисню.
Розв’язання
(O2)
=
![]() ;(O2)
=
;(O2)
=
![]() =10
моль;
=10
моль;
(O) = 2(O2) = 210 моль = 20 моль;
N(O) = (O)NA = 20 моль6,021023 моль1 = 1,2041025.
Таким чином, число атомів Оксигену становить 1,2041025.
6. Відносна густина пари речовини за повітрям становить 2. Визначити молярну масу цієї речовини.
Розв’язання
Dпов.=![]() ;
M=Dпов.М(пов.).
;
M=Dпов.М(пов.).
М(пов.) = 29 г/моль ; M = 2 29 г/моль = 58 г/моль.
Таким чином, молярна маса речовини 58 г/моль.
7. Обчислити, скільки молекул і атомів міститься в 11,2 л гідроген сульфуру за нормальних умов.
Розв’язання
N(H2S)
= (H2S)NA;
(H2S)
=
![]() ;
;
(H2S)
=
![]() =
0,5 моль.
=
0,5 моль.
N(H2S) = 0,5 моль6,021023 моль-1 = 3,011023 молекул.
Кожна молекула гідроген сульфіду містить 2 атоми Гідрогену і 1 атом Сульфуру, тобто кількість атомів у молекулі втричі більша.
Naтомів(H,S) = N(H2S) 3 = 33,011023 =9,031023 атомів.
Таким чином, кількість молекул 3,011023 ; кількість атомів – 9,031023 .
8. Визначити густину за воднем газової суміші, що складається з азоту об’ємом 56 л та неону об’ємом 28 л. Об’єми газів зведені до нормальних умов.
Розв’язання
![]() ;
;
Визначимо
молярну масу суміші:

M(сум.)
=
![]() .
.
Таким
чином,
![]() .
.
9. Визначити атомну масу двовалентного металу та встановити цей метал, якщо його 8,34 г окиснюється 0,680 л кисню (н.у.).
Розв’язання
Згідно
із законом еквівалентів
![]() .
.
Молярну масу еквівалента металу можна знайти так:
![]() г/моль.
г/моль.
Оскільки метал двовалентний, то його атомна маса обчислюється за формулою А=Mf(Me)2. Отже, атомна маса металу дорівнює 68,72=137.
Таким чином, шуканий метал барій.
10. Визначити молярну масу речовини, якщо 600 мл її пари при 87С і тиску 83,2 кПа дорівнює 1,30 г.
Розв’язання
Із рівняння МенделєєваКлапейрона можна виразити молярну масу речовини:
![]() г/моль.
г/моль.
Таким чином, молярна маса речовини дорівнює 78 г/моль.
11. Написати рівняння реакцій, що характеризують такі перетворення:
SO2Na2SO3NaHSO3Na2SO3Na2SO4.
Розв’язання
У ході пропускання SO2 через надлишок розчину натрій гідроксиду утворюється натрій сульфіт:
SO2 + 2NaOH Na2SO3 + H2O.
Під час пропускання надлишку SO2 через розчин натрій сульфіту утворюється натрій гідрогенсульфіт:
SO2 + Na2SO3 + H2O 2NaHSO3.
Натрій гідрогенсульфіт у процесі нагрівання розкладається:
2NaHSO3 SO2 + Na2SO3 + H2O.
Сульфатна кислота витісняє сульфітну кислоту із сульфітів:
Na2SO3 + H2SO4 Na2SO4 + SO2 + H2O.
